İlerlemiş veya metastatik kolanjiokarsinom tedavisinde ivosidenib FDA onayı aldı
25 Ağustos 2021'de FDA (ABD Gıda ve İlaç İdaresi), izositrat dehidrojenaz-1 (IDH1) mutasyonu pozitif, daha önce tedavi görmüş, bölgesel olarak ilerlemiş veya metastatik kolanjiokarsinomu (safra yolu kanseri) olan yetişkin hastalar için ivosidenib (Tibsovo) adlı tablet şeklinde alınan akıllı kanser ilacını onayladı. Ivosidenib, kolanjiokanserli hastalar için onaylanan 3. akıllı ilaç olmakla birlikte, IDH1 mutasyonlu kolanjiokanserli hastalar için onaylanan ilk akıllı ilaçtır.
Eş zamanlı olarak FDA, ivosidenib tedavisi için kolanjiokarsinomalı hastaların seçilmesine yardımcı olacak bir genetik test cihazı Oncomine Dx Hedef Testini (Life Technologies Corporation) de onayladı.
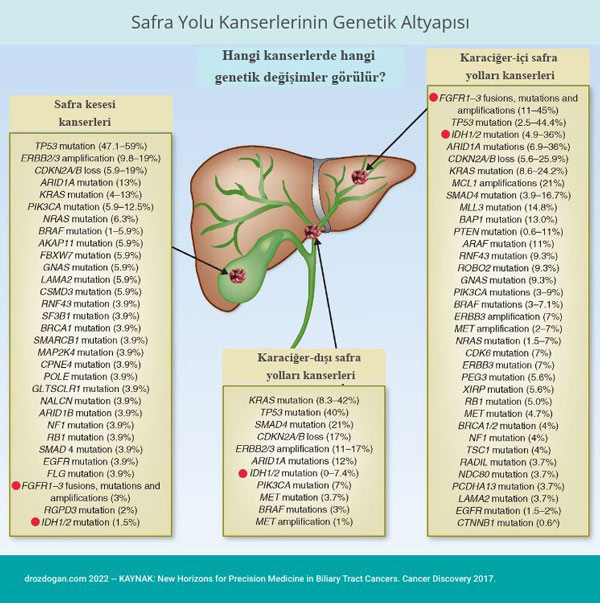
NOT: IDH1/2 genetik değişimleri, intrahepatik kolanjiokanserli hastaların yaklaşık %20'sinde meydana gelir.
Tibsovo, daha önce 2018'de IDH1 mutasyonu taşıyan relaps refrakter akut miyeloid lösemi (AML) ve 2019'da kemoterapiye uygun olmayan ve IDH1 mutasyonlu AML'li hastaların birinci basamak tedavisinde monoterapi olarak onaylanmıştı.
Kolanjiokanserli hastalar için FDA onayı alan önceki 2 akıllı ilaç ise şunlardır: Daha önce pemigatinib, 17 Nisan 2020'de fibroblast büyüme faktörü reseptörü-2 (FGFR2) mutasyonu pozitif kolanjiokarsinom için FDA onayı alan ilk ilaç olmuştu. 28 Mayıs 2021'de onay alan infigratinib ise, FGFR2 mutasyonu pozitif kolanjiokarsinom için FDA onayı alan 2. ilaç oldu.
Kolanjiyokarsinomların tedavisi, ortaya çıkan yeni hassas ilaç stratejileri ile hızla değişmektedir. Araştırmalar, intrahepatik kolanjiokarsinomalı (karaciğer içi safra yolu kanserli) hastaların yaklaşık % 40'ında FGFR2 füzyonları ve IDH1 mutasyonları saptamakatdır.
Ivosidenibe, kolanjiokanserde FDA onayı getiren çalışmalar
Ivosidenib, bir IDH1 mutasyonu olan lokal olarak ilerlemiş veya metastatik kolanjiokarsinomlu 185 yetişkin hasta üzerinde randomize (2:1), çok merkezli, çift kör, plasebo kontrollü bir klinik çalışma olan Study AG120-C-005'de araştırılmıştır. Hastanın hastalığı, en az bir gemsitabin veya 5-florourasil içeren rejim dahil olmak üzere en az bir, ancak ikiden fazla olmayan önceki rejimden sonra ilerlemiş olmalıdır. Hastalar, hastalık progresyonuna veya kabul edilemez toksisiteye kadar günde bir kez oral olarak 500 mg ivosidenib veya eşleştirilmiş plasebo alacak şekilde randomize edilmiştir.
Çalışmada ölçülmek istenen birincil etkinlik sonlanım noktası, bağımsız inceleme komitesi tarafından RECIST 1.1'e göre belirlendiği üzere progresyonsuz sağkalım (PFS) idi.
Sonuçlar
- Ivosidenib alan hastalar için PFS'de istatistiksel olarak anlamlı bir iyileşme gözlendi (HR 0.37; %95 GA: 0.25, 0.54; p<0.0001). Yani, hastaların ivosidenib alması, kanserde progresyon riskini %63 azalttı.
- Genel sağkalım analizi ise istatistiki olarak anlamlı değildi (0.79; %95 GA: 0.56, 1.12; p=0.093). Başlangıçta plasebo hastaların %70'i, radyolojik hastalık progresyonundan sonra ivosidenib almak için geçiş yapmıştır. Genel sağkalımda anlamlı fark çıkmamasının sebebi bu olabilir.
Kolanjiokarsinomlu hastalarda en yaygın (≥%15) yan etkiler yorgunluk, bulantı, karın ağrısı, ishal, öksürük, iştah azalması, asit (karında sıvı), kusma, anemi ve döküntüdür.
Kolanjiokarsinom için önerilen ivosidenib dozu, hastalık progresyonuna veya kabul edilemez toksisiteye kadar, yemekle birlikte veya yemeksiz olarak günde bir kez 500 mg'dır.
FDA approves ivosidenib for advanced or metastatic cholangiocarcinoma. fda.gov 25 August 2021.