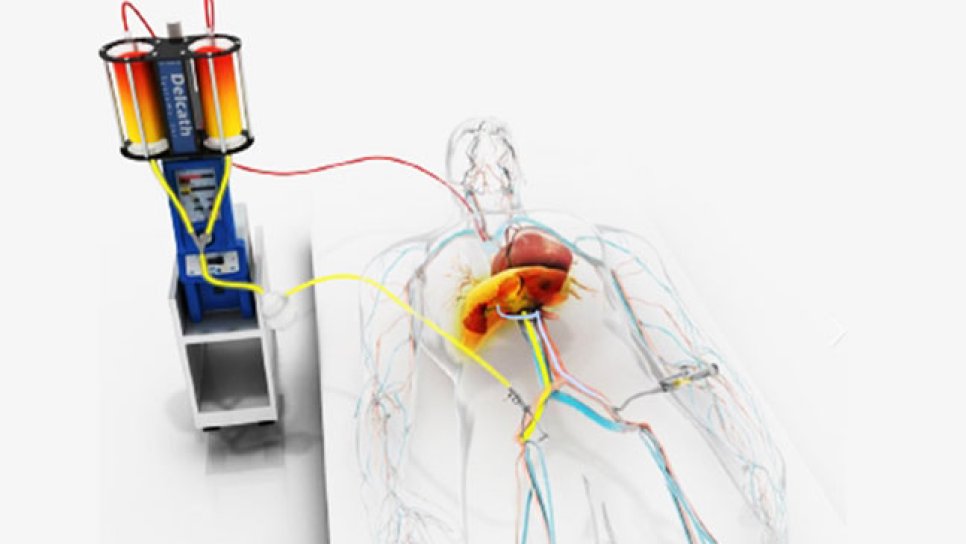
Metastatik Uveal Melanom İçin Melphalan Hepatik Tedavisini FDA Onayı Aldı
14 Ağustos 2023'te, FDA (Amerikan Gıda ve İlaç İdaresi), melphalan içeren HEPZATO KIT'i (melphalan için Enjeksiyon/Karaciğer İleti Sistemi) (HEPZATO, Delcath Systems, Inc.), karaciğerin %50'sinden azını etkileyen ve tedavi edilemeyen karaciğer metastazları bulunan veya kemik, lenf düğümleri, deri altı dokuları veya akciğerle sınırlı karaciğer-dışı hastalığı olan ve cerrahi müdahale veya radyoterapi ile tedavi edilebilen yetişkin uveal melanoma hastaları için onayladı.
Uveal Melanom Nedir?
Uveal (göz) melanom, deri kanserlerinin %5 kadarını oluşturan ve agresif gidişata sahip olan malign melanomun nadir bir alt türüdür. Uveal melanom, gözün pigment hücrelerinde başlar (bakınız aşağıdaki şekil).
Melanomların çoğu cilt yüzeyi kaynaklıdır ve bu türler için pembrolizumab gibi immünoterapiler çoğu hastada etkilidir, ancak intraoküler (göz içi) melanomlarda bu immünoterapiler zayıf kalmaktadır. Uveal melanom hastalarının yaklaşık %50’si tanı anında metastatik (4. evre) evrededir ve en yaygın olarak karaciğerde metastaz vardır; bu durum kötü prognoz (hastalık gidişatı) ile ilişkilidir.
Melphalan Nedir? Etki Mekanizması Nasıldır?
Melphalan, alkile edici ajan sınıfından bir kemoterapi ilacıdır. Nitrojen mustard analoğudur. DNA'nın çift sarmal yapısını bozar ve hücre bölünmesini engeller. Bu, kanser hücrelerinin büyümesini ve çoğalmasını durdurur, böylece kanserin yayılmasını engeller.
Melphalan, özellikle multipl miyelom (bir tür kemik iliği kanseri) tedavisinde kullanılmaktadır. Ayrıca, bazı over (kadın yumurtalık) kanseri türlerinin tedavisinde de kullanılmıştır. Melphalan, 1950'lerden beri kullanılmakta olup, FDA tarafından 1964 yılında multipl miyelom tedavisi için onaylanmıştır.
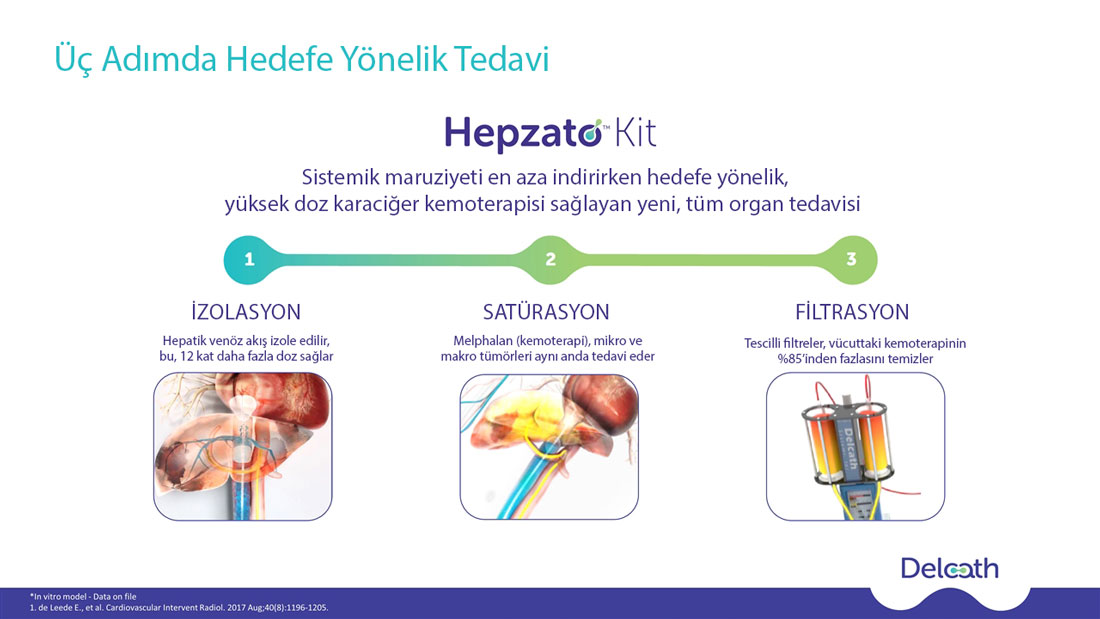
FOCUS Çalışması ile gelen FDA onayı
Etkililik, 91 hastada uveal melanoma ile tedavi edilemez karaciğer metastazları olan FOCUS çalışmasında değerlendirildi.
- Objektif yanıt oranı (%36,3 (95% CI: 26,4, 47) ve
- yanıt süresinin ortanca değeri 14 aydı (95% CI: 8,3, 17,7).
Melphalan, Hepatic Delivery System (HDS) kullanılarak karaciğer arterine, 6 ila 8 haftada bir olmak üzere toplamda en fazla 6 infüzyon şeklinde uygulanır.
Önerilen melphalan dozu, ideal vücut ağırlığına dayalı olarak 3 mg/kg'dır, tek bir tedavi sırasında maksimum doz 220 mg'dır.
İLGİLİ KONULAR
Uyarılar ve Kontrendikasyonlar
HEPZATO KIT'in reçete bilgilerinde, işlem sırasında ortaya çıkabilecek ciddi komplikasyonlar, kanama, karaciğer hücre hasarı ve pıhtı atması gibi durumlar için özel bir Kutulu Uyarı yer almaktadır. Ayrıca, kemik iliği baskılanması sonucu ortaya çıkabilecek ciddi enfeksiyon, kanama veya belirgin anemi durumları için de benzer bir uyarı bulunmaktadır.
Bu tedavinin en yaygın yan etkileri veya laboratuvar anormallikleri ise şunlar olarak belirlenmiştir: trombosit sayısında azalma (trombositopeni), yorgunluk, kansızlık (anemi), mide bulantısı, kas ve iskelet sistemi ağrıları, beyaz kan hücresi sayısında azalma (lökopeni), karın ağrısı, nötrofil sayısında azalma (nötropeni), kusma, karaciğer enzimlerinde artış (alanin aminotransferaz), pıhtılaşma süresinde uzama (aktive parsiyel tromboplastin zamanı), başka bir karaciğer enziminde artış (aspartat aminotransferaz), kan alkalen fosfataz düzeyinde artış ve nefes darlığı (dispne).
Sonuç
Bu onay, uveal melanoma tedavisinde önemli bir adımı temsil etmektedir. Karaciğer atardamarından melphalanın uygulanması ve etkili bulunması, hastalar için yeni bir umut kaynağı olabilir. Ancak, tedavi ile ilişkili riskler ve yan etkiler, hastaların ve sağlık profesyonellerinin dikkatli bir değerlendirme yapmasını gerektirmektedir.
FDA approves melphalan as a liver-directed treatment for uveal melanoma. 14 August 2023. fda.gov






