HLA-A*02:01-pozitif, cerrahi olarak çıkarılamayan veya metastatik uveal (göz) melanomlu yetişkin hastaların tedavisi için, bir T-hücre güçlendirici protein yapıda molekül olan tebentafusp-tebn (Kimmtrak, Immunocore Limited), 25 Ocak 2022'de FDA (ABD Gıda ve İlaç İdaresi) onayı aldı.
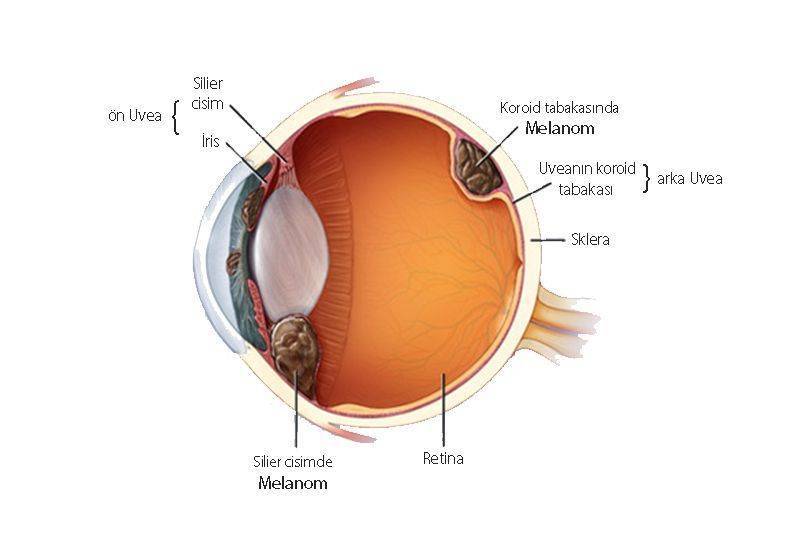
Göz Melanomu Nedir?
Uveal (göz) melanom, deri kanserlerinin %5 kadarını oluşturan ve agresif gidişata sahip olan malign melanomun nadir bir alt türüdür. Uveal melanom, gözün pigment hücrelerinde başlar (bakınız aşağıdaki şekil).
Melanomların çoğu cilt yüzeyi kaynaklıdır ve bu türler için pembrolizumab gibi immünoterapiler çoğu hastada etkilidir, ancak intraoküler (göz içi) melanomlarda bu immünoterapiler zayıf kalmaktadır. Uveal melanom hastalarının yaklaşık %50’si tanı anında metastatik (4. evre) evrededir ve en yaygın olarak karaciğerde metastaz vardır; bu durum kötü prognoz (hastalık gidişatı) ile ilişkilidir.
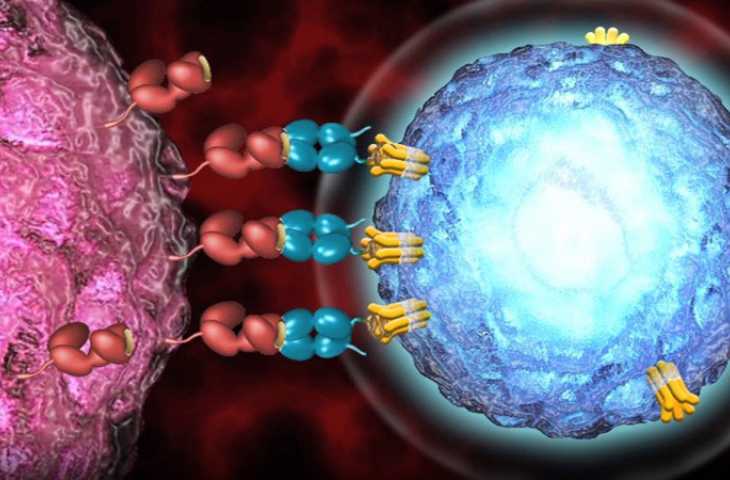
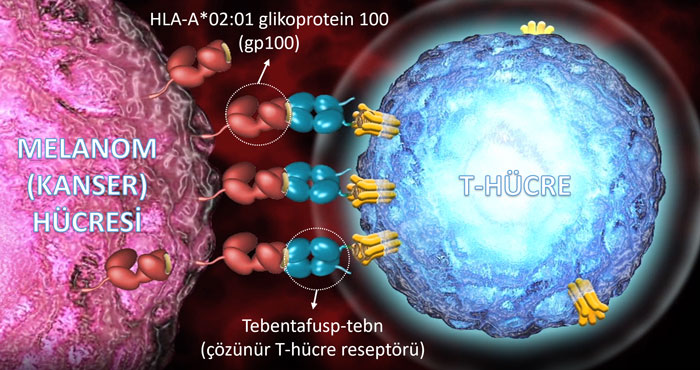
Kimmtrak Etki Mekanizması Nasıldır?
Etken maddesi tebentafusp (kod adı IMCgp100) olan Kimmtrak adlı ilaç, uveal melanom hücrelerinin yüzeyinde sunulan HLA-A*02:01 glikoprotein 100'e (gp100) güçlü bir şekilde bağlanan çözünür bir T-hücre reseptörü ve anti-CD3 antikordan oluşur.
gp100 proteini, melanom hücreleri tarafından yüksek oranda, normal melanositler diğer dokular tarafından ise zayıf ifade edilen tümörle ilişkili bir antijendir (TAA).
FDA Onayı Getiren IMCgp100-202 Çalışması
Tebentafuspun etkinliği, metastatik uveal melanomlu 378 hastanın katıldığı randomize, açık etiketli, çok merkezli bir çalışma olan IMCgp100-202'de değerlendirilmiştir. Hastaların, test ile HLA-A*02:01 genotip pozitif olması gerekiyordu. Daha önce herhangi bir tedavi almış hastalar (sistemik tedavi veya lokalize karaciğere yönelik tedavi) çalışma dışı bırakıldı. Oligometastatik hastalığın önceki cerrahi rezeksiyonuna izin verildi. Klinik olarak anlamlı kalp hastalığı veya semptomatik, tedavi edilmemiş beyin metastazı olan hastalar çalışma dışı bırakıldı.
252 hasta tebentafusp-tebn, 126 hasta araştırmacının tercihine göre pembrolizumab, ipilimumab veya dakarbazin almak üzere 2:1 oranında randomize edildi. Tebentafusp-tebn, hastalık progresyonuna veya kabul edilemez toksisiteye kadar her hafta 1. günde 20 mcg, 8. günde 30 mcg, 15. günde 68 mcg ve müteakip haftalarda intravenöz infüzyon yoluyla uygulandı. Ana etkinlik sonuç ölçüsü genel sağkalım idi. Ek bir etkinlik sonucu, RECIST 1.1'e göre araştırmacı tarafından değerlendirilen progresyonsuz (ilerlemesiz) sağkalım (PFS) olmuştur.
Bu çalışmanın 3 yıllık sağkalım oranı verileri 14 Aralık 2023'te NEJM dergisinde yayımlandı.
Sonuçlar
- Ortanca genel sağkalım, tebentafusp ile tedavi edilen hastalar için 21.6 ay (%95 GA: 18.6, 28.6) ve araştırmacının seçtiği kolda 16.9 ay (%95 GA: 9.7, 18.4) idi (HR=0.51, %95 GA: 0.37, 0.71 , p<0.0001).
- Tebentafusp alanlar için ortanca progresyonsuz sağkalım 3.3 ay (%95 GA: 3-5) ve araştırmacının seçtiği kolda 2.9 aydı (%95 GA: 2,8-3) idi (HR=0.73, 95% CI: 0.58, 0.94, p=0.0139).
- 3. yılda tebentafusb kolu için sağkalım oranı %27 iken, kolntrol kolunda %18 idi.

Yan etkiler
En yaygın advers reaksiyonlar (≥%30) sitokin salınım sendromu, döküntü, ateş, kaşıntı, yorgunluk, bulantı, titreme, karın ağrısı, ödem, hipotansiyon, kuru cilt, baş ağrısı ve kusmaydı. En yaygın laboratuvar anormallikleri (≥%50), lenfosit sayısında azalma, kreatinin artışı, glikoz artışı, aspartat aminotransferaz artışı, alanin aminotransferaz artışı, hemoglobin azalması ve fosfat azalmasıydı.
Tebentafusp ile sitokin salıverilme sendromu yaygın olmasına rağmen (% 89), 3–4 derece sitokin salıverilme sendromu oranı çok düşüktü (% 1).
Doz
İntravenöz olarak uygulanan önerilen tebentafusp-tebn dozu:
- 1. günde 20 mcg,
- 8. günde 30 mcg,
- 15. günde 68 mcg ve
- Daha sonra haftada bir kez 68 mcg.
*
Immunocore, çözünür T hücre reseptör teknolojisini kullanarak biyolojik ilaçları araştıran ve geliştiren, Oxfordshire Birleşik Krallık merkezli ve 2008 yılından bu yana faaliyet gösteren küresel bir klinik aşamalı biyoteknoloji şirketidir.
Aşağıdaki video, şirket tarafından tebentafusp-tebn etki mekanizmasını anlatmak için hazırlanmıştır.