Özofagus ve özofagus-mide bileşke kanseri başlangıç tedavisi pembrolizumab FDA onayı aldı
Metastatik veya bölgesel olarak ilerlediği için ameliyat edilemeyen veya definitif radyoterapiye aday olmayan özofagus veya gastroözofageal bileşke kanserli hastalar için platin ve floropirimidin bazlı kemoterapi ile kombinasyon halinde pembrolizumab (Keytruda) adlı immünoterapiye 22 Mart 2021 tarihinde FDA (ABD Gıda ve İlaç İdaresi) onay verdi.
KEYNOTE-590 çalışması ile gelen FDA onayı
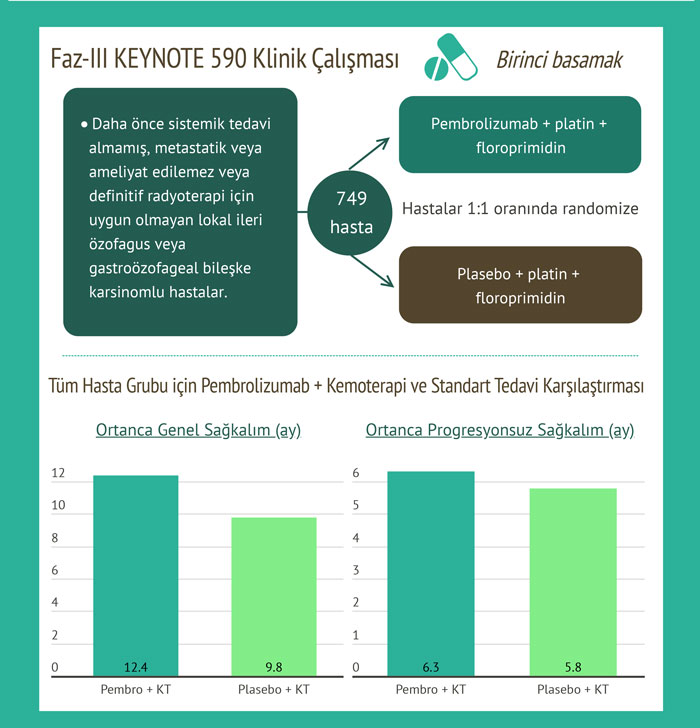
Etkinlik, cerrahi rezeksiyon veya kesin kemoradyasyon için aday olmayan metastatik veya lokal olarak ilerlemiş özofagus veya gastroözofageal bileşke karsinomu olan 749 hastayı içeren çok merkezli, randomize, plasebo kontrollü bir çalışma olan KEYNOTE-590'da (NCT03189719) değerlendirilmiştir. PD-L1 durumu, PD-L1 IHC 22C3 PharmDx kiti kullanan tüm hastalarda tümör örneklerinde merkezi olarak belirlendi. Hastalar, kabul edilemez toksisite veya hastalık progresyonuna (ilerlemesi) kadar, sisplatin ve fluorouracil ile kombinasyon halinde pembrolizumaba veya sisplatin ve fluorourasil ile birlikte plasebo için 1:1 oranında randomize edildi.
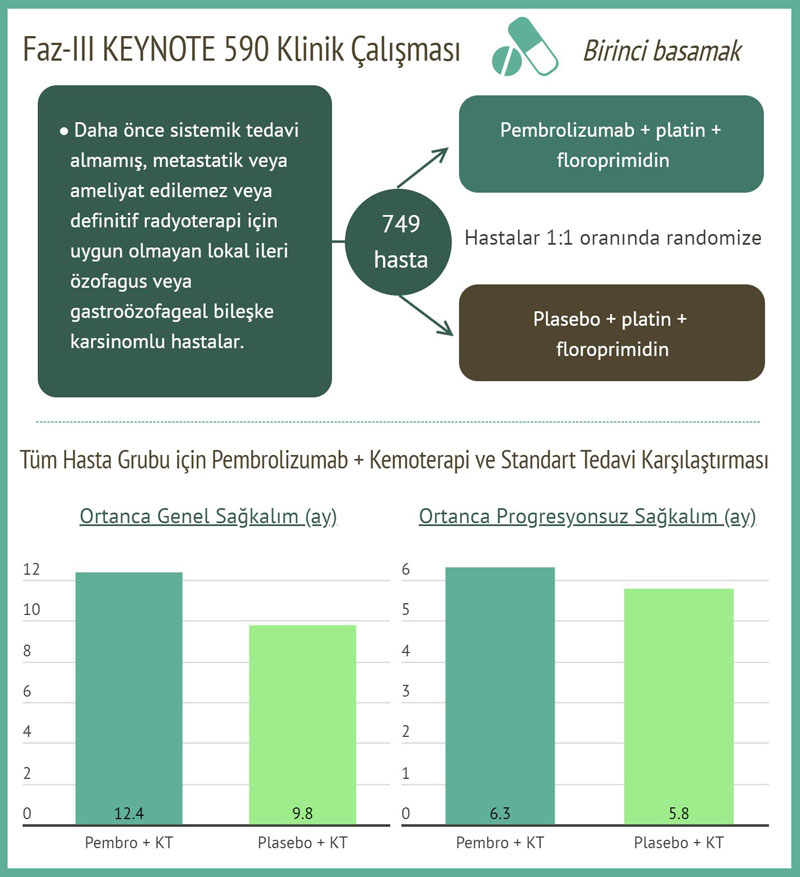
RECIST 1.1'e göre (organ başına maksimum 10 hedef lezyonu ve maksimum 5 hedef lezyonu takip edecek şekilde modifiye edilmiştir) araştırmacı tarafından değerlendirilen ana etkililik sonuç ölçütleri genel sağkalım (OS) ve progresyonsuz sağkalımdır (PFS). Çalışma, kemoterapi ile pembrolizumaba randomize edilen hastalarda OS ve PFS'de istatistiksel olarak anlamlı bir iyileşme gösterdi. Medyan OS pembrolizumab kolu için 12,4 ay (% 95 CI: 10,5, 14,0) iken kemoterapi kolu için 9,8 ay (% 95 CI: 8,8, 10,8) (HR 0,73;% 95 CI: 0,62, 0,86; p <0,0001) . Medyan PFS sırasıyla 6.3 (% 95 CI: 6.2, 6.9) ve 5.8 ay (% 95 CI: 5.0, 6.0) idi (HR 0.65;% 95 CI: 0.55, 0.76; p <0.0001).
KEYNOTE-590'da pembrolizumab kombinasyonunu alan hastaların ≥% 20'sinde bildirilen en yaygın advers reaksiyonlar mide bulantısı, kabızlık, ishal, kusma, stomatit, yorgunluk / asteni, iştah azalması ve kilo kaybıdır.
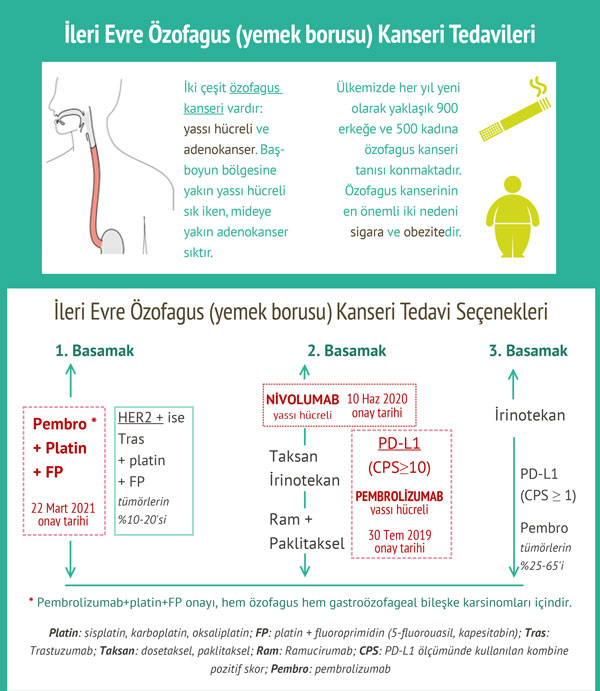
Özofagus kanseri için önerilen pembrolizumab dozu 3 haftada bir 200 mg veya 6 haftada bir 400 mg'dır.
FDA approves pembrolizumab for esophageal or GEJ carcinoma. fda.gov 22 March 2021