Keytruda (pembrolizumab) İmmünoterapisi Nedir? Hangi Kansere İyi Gelir? Yan Etkileri
Keytruda nedir?
Etken maddesi pembrolizumab olan Keytruda adlı ilaç, bağışıklık sisteminin kanser hücrelerini tespit etme ve kanser hücrelerine saldırma yeteneğini geliştirmek için tasarlanmış bir immünoterapidir. 2006 yılında üzerinde çalışılmaya başlanan pembrolizumabın geliştiricileri Gregory Carven, Hans Van Eenennaam ve John Dulos 2016 yılında Fikri Mülkiyet Sahipleri Eğitim Vakfı (Intellectual Property Owners Education Foundation) tarafından yılın mucidi seçilmiştir.
Keytruda fiyat
Haziran 2023 itibarı ile, Keytruda 100 mg / 4 ml fiyatı 49.932 TL olarak belirlenmiştir. Her 3 haftada bir uygulanan 1 siklusta 200 ml (yani 2 kutu) kullanılmaktadır.
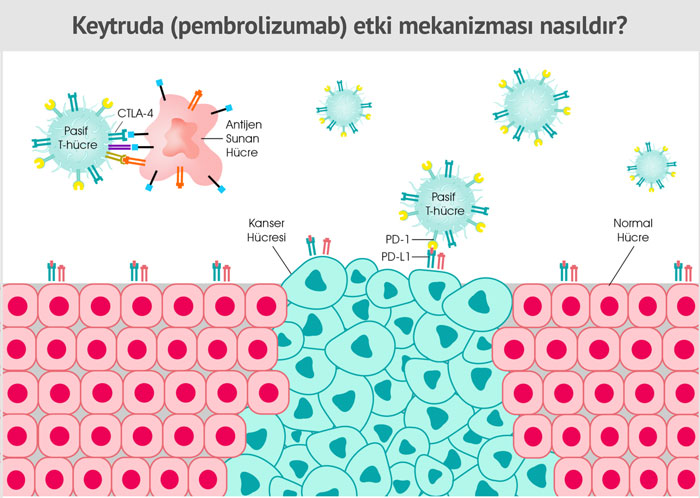
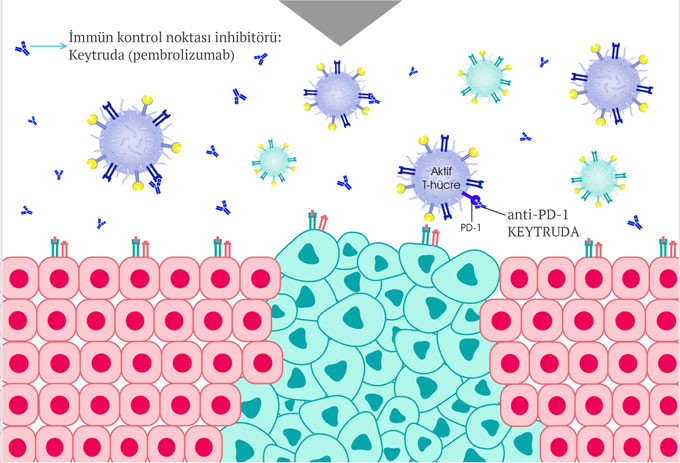
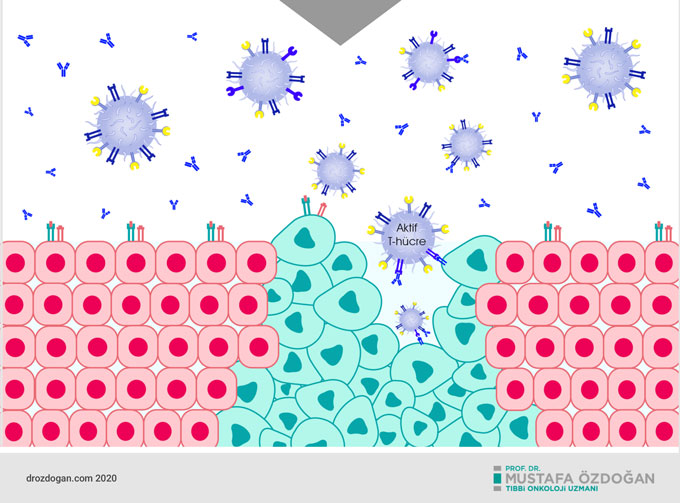
Keytruda etki mekanizması nasıldır?
Keytruda, bağışıklık sisteminin T hücreleri üzerinde bulunan PD-1 reseptörüne bağlanarak etki göstermektedir. PD-1, uyarıcı moleküllerine bağlandığında bağışıklık hücrelerini, dolayısı ile bağışıklık sistemini baskılayan bir yüzey molekülüdür. Keytruda ise PD-1 reseptörüne bağlanarak, uyarıcı moleküllerden hem PD‑L1 hem de PD‑L2'nin PD-1 ile etkileşime girmesini bloke eder ve T hücre yanıtını geri kazanmaya yardımcı olup, bağışıklık sisteminin aktif olmasını sağlar. Böylece bağışıklık sistemi çalışmasını sürdürebilmektedir. Bununla birlikte bu yöntem tüm kanser türlerinde işe yaramaz, çünkü kanser hücrelerinin, bağışıklık sisteminden gizlenmek için bu kontrol noktasından başka hücresel mekanizmaları da kullanır.
Keytruda ne için kullanılır?
Keytruda genellikle tümörleri küçültmek ve hastalığın belirtilerini azaltıp hastanın yaşam süresini (sağkalım) uzatmak amacıyla verilir; yani çoğunlukla ileri (4.) evre kanserlerde kullanılır. Bununla birlikte Ocak 20202'de erken evre yüksek riskli mesane kanseri tedavisi için FDA onayı almıştır.
Keytruda şimdiye kadar 15 farklı solid (organ) kanserin tedavisinde ABD Gıda ve İlaç İdaresi (FDA) onayı aldı. Ayrıca, 2 farklı durum için de organdan bağımsız FDA onayı bulunmakta: MSI-yüksek ve TMB-yüksek ileri evre tümörler. Bunlar tümörün köken aldığı organdan bağımsız genetik biyobelirteçlere göre verilmiş onaylardır.
Keytruda FDA onay tarihleri
- 4 Eylül 2014: Diğer ilaçlara yanıt vermeyen ilerlemiş veya cerrahi olarak çıkarılamayan melanomlu hastaların tedavisinde
- 2 Ekim 2015: Diğer tedavilerden sonra hastalığı ilerlemiş olan, tümörlerin PD-L1 ekspresyonu belirlenmiş olan ileri evre (metastatik) küçük hücre dışı akciğer kanseri tedavisi
- 18 Aralık 2015: Rezeke edilemeyen (cerrahi olarak çıkarılamayan) veya metastatik melanomlu hastaların birinci basamak tedavisi
- 5 Ağustos 2016: Platin içeren kemoterapi sırasında veya sonrasında hastalık progresyonu (hastalığın ilerlemesi devam eden) olan nükseden veya metastatik baş ve boyun skuamöz hücreli karsinomlu hastaların tedavisi için her üç haftada bir 200 mg'lık sabit bir dozda kullanımı
- 24 Ekim 2016: FDA onaylı bir test ile tümörlerin yüksek oranda PD-L1 eksprese ettiği (Tümör Oran Skoru en az yüzde 50) belirlenmiş, EGFR ve ALK genomik tümör aberasyonu olmayan, metastatik küçük hücreli dışı akciğer kanseri hastalarının birinci basamak tedavisi
- 15 Mart 2017: Daha önce en az üç basamak tedavi almış ve relaps olan, refrakter klasik Hodgkin lenfomalı yetişkin ve pediyatrik hastaların tedavisi için
- 10 Mayıs 2017: Pemetreksed ve karboplatin ile kombinasyon halinde, PD-L1 ekspresyonundan bağımsız olarak metastatik nonskuamöz küçük hücre dışı akciğer kanseri birinci basamak tedavisinde
- 18 Mayıs 2017: Sisplatin içeren kemoterapi için uygun olmayan lokal olarak ilerlemiş veya metastatik ürotelyal karsinomlu hastaların birinci basamak tedavisi
- 23 Mayıs 2017: Mikrosatellit instabilitesi-yüksek (MSI-H) veya uyumsuz onarım eksikliği (dMMR) biyobelirteç ile tespit edilmiş, rezekte edilemeyen veya metastatik solid tümörleri olan yetişkin ve pediyatrik hastaların tedavisi (FDA ilk defa bir tümörün orjinal konumuna bakmaksızın tümörün biyobelirtecine bağlı onay vermiştir.)
- 22 Eylül 2017: Floropirimidin, platin içeren kemoterapi ve uygunsa HER2 / neu hedefli tedavi dahil olmak üzere en az 2 basamak tedavi almış ve tedaviler sırasında veya sonrasında hastalık ilerlemesi devam etmiş, FDA onaylı bir test ile tümörlerin PD-L1 eksprese ettiği (Kombine Pozitif Skor≥1) belirlenmiş, nükseden lokal olarak ilerlemiş veya metastatik gastrik veya gastroözofageal bileşke adenokarsinomu olan hastaların tedavisi
- 12 Haziran 2018: Kemoterapi sırasında veya sonrasında hastalık ilerlemesi olan FDA onaylı bir test ile tümörlerin PD-L1 eksprese ettiği (Kombine Pozitif Skor≥1) belirlenmiş, nükseden veya metastatik servikal kanserli hastaların tedavisi
- 13 Haziran 2018: Daha önce en az 2 basmak tedavi görmüş ve relaps olmuş, refrakter primer mediastinal büyük B hücreli lenfoma olan yetişkin ve pediyatrik hastaların tedavisi
- 21 Ağustos 2018: Pemetrekset ve platin kemoterapisi ile kombine olarak daha önce tedavi almamış (birinci basamak) EGFR ve ALK genomik tümör aberasyonu olmayan metastatik nonskuamöz küçük hücre dışı akciğer kanseri tedavisinde
- 30 Ekim 2018: Karboplatin ve Paklitaksel/Nab-Paklitaksel kemoterapisi ile kombine olarak metastatik skuamöz küçük hücreli olmayan akciğer kanseri olan hastaların ilk basamak tedavisi
- 9 Kasım 2018: Daha önce sorafenib kullanmış, hepatoselüler karsinomlu hastaların tedavisi
- 19 Aralık 2018: Tekrarlayan, lokal ileri veya metastatik merkel hücreli karsinomlu yetişkin ve pediatrik hastaların tedavisi
- 19 Şubat 2019: Tam rezeksiyon sonrası lenf nodları tutulumu olan melanomlu hastaların adjuvan tedavisi
- 11 Nisan 2019: Cerrahi olarak çıkarılamayan veya kemoradyasyona uygun olmayan evre III veya metastatik, FDA onaylı bir test ile tümörlerin PD-L1 eksprese ettiği (Tümör Oran Skoru≥1) belirlenmiş EGFR veya ALK genomik tümör aberasyonları olmayan küçük hücre dışı akciğer kanseri tedavisi
- 22 Nisan 2019: Tirozin kinaz inhibitörü olan InlytaI (axitinib) ile kombinasyon halinde, ilerlemiş renal hücreli karsinomlu hastaların birinci basamak tedavisi
- 11 Haziran 2019: Tümörlerin PD-L1 eksprese ettiği (Kombine Pozitif Skor≥1) belirlenmiş hastalarda monoterapi olarak veya platin ve florourasil (FU) ile kombinasyon halinde, metastatik veya tümörleri cerrahi olarak çıkarılamayan, tekrarlayan baş ve boyun skuamöz hücreli karsinomu olan hastaların birinci basamak tedavisi
- 18 Haziran 2019: Platin bazlı kemoterapi sırasında veya sonrasında hastalık progresyonu olan ve en az bir basamak tedavi almış metastatik küçük hücreli akciğer kanseri tedavisi
- 31 Temmuz 2019: Daha önce en az bir basamak tedavi almış, tekrarlayan lokal ileri veya metastatik FDA onaylı bir test ile tümörlerin PD-L1 eksprese ettiği (Kombine Pozitif Skor≥10) belirlenmiş skuamöz hücreli özafagus kanseri tedavisi
- 17 Eylül 2019: Önceki sistemik tedaviyi takiben hastalık ilerlemesi gösteren ve küratif cerrahi veya radyasyon için uygun olmayan (MSI-H) veya (dMMR) bulunmayan ileri evre endometriyal karsinoma tedavisinde kinaz inhibitörü Lenvima ile kombine kullanımı
- 8 Ocak 2020: Bacillus Calmette-Guerin (BCG) tedavisine yanıtsız, yüksek riskli, kasa invazif olmayan mesane kanseri tedavisi
- 28 Nisan 2020: Tüm onaylanmış yetişkin endikasyonları için önerilen dozlara ek olarak 6 haftada bir 400 mg'lık dozda kullanımı
- 17 Haziran 2020: Tümör tipine bakılmaksızın, önceki tedaviyi takiben ilerleme gösteren, alternatif tedavisi olmayan, rezeke edilemeyen (cerrahi olarak çıkarılamayan) veya metastatik, FDA onaylı bir test ile tümör mutasyon yükü-yüksek (TMB-H) [≥10 mutasyon/megabaz] olduğu belirlenmiş, solid tümörleri olan yetişkin ve pediyatrik hastaların tedavisi için (ikinci biyobelirteç)
- 24 Haziran 2020: Cerrahi veya radyasyonla tedavi edilemeyen tekrarlayan veya metastatik kutanöz skuamöz hücreli karsinomlu hastaların tedavisi
- 29 Haziran 2020: Rezeke edilemeyen (cerrahi olarak çıkarılamayan) veya metastatik MSI-H veya dMMR kolorektal kanseri olan hastaların birinci basamak tedavisi
- 14 Ekim 2020: Tekrarlamış veya tedaviye dirençli klasik Hodgkin lenfoma tedavisinde endikasyonu 3. basamak ve sonrasından 2. basamak ve sonrası olarak genişletildi.
- 13 Kasım 2020: Tümörleri PD-L1 (CPS ≥10) yönünden pozitif olan, metastatik veya bölgesel olarak tekrarlamış ameliyat edilemeyen üçlü negatif meme kanseri olan hastaların tedavisi için kemoterapi ile birlikte hızlandırılmış onay aldı.
- 1 Mart 2021: ABD ve Kanada dışında MSD olarak bilinen Merck, platin bazlı kemoterapi ve önceki en az bir diğer tedavi sırasında veya sonrasında hastalık progresyonu olan metastatik küçük hücreli akciğer kanseri tedavisi için endikasyonunu gönüllü olarak geri çektiğini duyurdu.
- 22 Mart 2021: Metastatik veya bölgesel olarak ilerlediği için ameliyat edilemeyen veya definitif radyoterapiye aday olmayan özofagus veya gastroözofageal bileşke kanserli hastaların birinci basamak tedavisi için platin ve floropirimidin bazlı kemoterapi ile kombinasyon halinde onaylandı.
- 5 Mayıs 2021: Bölgesel olarak ilerlediği için ameliyat edilemeyen veya metastaz yapmış HER2 pozitif mide veya gastroözofageal bağlantı (GEJ) adenokarsinomu olan hastaların birinci basamak tedavisi için trastuzumab, floropirimidin ve platin içeren kemoterapi ile kombinasyon halinde hızlandırılmış onay aldı.
- 1 Temmuz 2021: Tümörleri PD-L1 [kombine pozitif skor (CPS ≥1)] eksprese eden, tekrarlayan lokal olarak ilerlemiş veya metastatik gastrik veya gastroözofageal bileşke (GEJ) adenokarsinomu olan hastaların 3. basamak tedavi onayı firma tarafından geri çekildi.
- 6 Temmuz 2021: Cerrahi veya radyoterapi ile tedavi edilemeyen, tekrarlayan veya metastatik kutanöz skuamöz hücreli karsinomu olan hastalar için onaylandı.
- 26 Temmuz 2021: Neoadjuvan tedavi olarak kemoterapi ile birlikte ve ardından ameliyat sonrası adjuvan tek bir ajan olarak devam edecek şekilde yüksek riskli, erken evre, üçlü (triple) negatif meme kanseri için onaylandı.
- 10 Ağustos 2021: İleri evre renal hücreli karsinom birinci basamak tedavisi. CLEAR çalışması ile PD-L1'den bağımsız onay aldı. Pembrolizumab ile lenvatinib alan hastaların ortanca PFS 23,9 ay, sunitinib ile 9.2 ay. Objektif yanıt oranları %71'e karşı %36. Tam yanıt oranları %16 ve %4.
- 13 Ekim 2021: Tedaviye dirençli, tekrarlayan veya metastatik PD-L1 pozitif (CPS ≥1) serviks kanseri birinci basamakta bevasizumab ile birlikte veya beva olmadan kemoterapiye pembrolizumab ekleniyor. KEYNOTE-826 çalışması. Yaşam kaybı riskini %36 azalttı, PFS 10,4 vs 8,2 ay.
- 17 Kasım 2021: Renal hücreli karsinom adjuvan tedavisi. Tekrarlama açısından orta-yüksek riskli RCC adjuvan tedavisinde. RCC adjuvan tedavisi için ilk immünoterapi onayı. KEYNOTE-564 çalışması 994 hasta alındı. Pembro kolunda 109 (%22) olay ve plaseboda 151 (%30) olay. Hastalıksız sağkalım için HR 0.68.
- 3 Aralık 2022: Evre IIB ve IIC melanom adjuvan tedavisi. Evre IIB veya IIC melanomlu yetişkin ve pediatrik (≥12 yaş) hastalarda, tümörün tam rezeksiyonu sonrasında adjuvan tedavi. Kanserin tekrarlama riskini %35 azaltı.
- 21 Mart 2022: Küratif cerrahi veya radyoterapi için aday olmayan ileri evre endometriyal karsinom. MSI-H veya dMMR olan, daha önce herhangi bir ortamdaki sistemik tedaviyi takiben kanseri ilerleyen ileri evre endometriyal karsinomda tek ajan. Objektif yanıt oranı %46 idi (%95 GA: 35, 56). Ortanca yanıt süresine ulaşılamadı (2.9 ile 55.7+).

Keytruda, Türkiye'de SGK geri ödeme kapsamında mıdır?
Keytruda ülkemizde şimdiye kadar herhangi bir kanserin tedavisi için T.C. Alie, Çalışma ve Sosyal Hizmetler Bakanlığı'na bağlı olan Sosyal Güvenlik Kurumu (SGK) tarafından geri ödeme kapsamına alınmamıştır. Bununla birlikte Keytruda, aşağıdaki kanserleri için Sağlık Bakanlığı tarafından ruhsatlandırılmıştır:
Melanom
KEYTRUDA’nın, rezeke edilemeyen veya metastatik malign melanoma tedavisinde daha önce en az bir seri sistemik tedaviden sonra hastalık progresyonu gösteren ECOG performans skoru (PS) 0-1 olan, daha önce PD-1 ve PD-L1 inhibitör tedavisi almayan hastaların tedavisinde progresyona kadar kullanımı endikedir.
Küçük Hücreli Dışı Akciğer Kanseri (KHDAK)
KEYTRUDA’nın, ECOG PS 0-1 olan, yeterli kardiyak, renal ve hepatik fonksiyonları bulunan, aktif beyin metastazı olmayan, skuamöz olmayan KHDAK’de EGFR ve ALK mutasyonları bulunmayan, eş zamanlı immunsupresif veya kortikosteroid tedavisi almayan metastatik KHDAK’de, PD-L1 ekspresyonu %50 ve üzerinde olan hastaların birinci basamak tedavisinde progresyona kadar kullanımı endikedir. Tedavi sonu progresyonda diğer PD-1, PD-L1 inhibitörleri kullanılamaz. Pembrolizumab tedavisi tıbbi onkologlarca planlanıp uygulanmalıdır.
KEYTRUDA, ECOG PS 0-1 olan, yeterli kardiyak, renal ve hepatik fonksiyonları bulunan, aktif beyin metastazı olmayan, EGFR ya da ALK mutasyonları bulunmayan ve eş zamanlı immünsüpresif veya kortikosteroid tedavisi almayan metastatik skuamöz olmayan KHDAK hastalarının birinci basamak tedavisinde, platin ve pemetrekset kemoterapi rejimi ile kombine olarak progresyona kadar kullanımı endikedir. Tedavi sonu progresyonda diğer PD-1 ve PD- L1 inhibitörleri kullanılamaz.
KEYTRUDA, ECOG PS 0-1 olan, yeterli kardiyak, renal ve hepatik fonksiyonları bulunan, aktif beyin metastazı olmayan, eş zamanlı immünsupresif ve kortikosteroid tedavisi almayan, metastatik skuamöz KHDAK hastalarının birinci basamak tedavisinde karboplatin ve paklitaksel veya nab-paklitaksel’den herhangi biri ile kombine olarak progresyona kadar kullanımı endikedir. Tedavi sonu progresyonda diğer PD-1 ve PD-L1 inhibitörleri kullanılamaz.
Ürotelyal Karsinom
KEYTRUDA, ECOG PS 0-1 olan, platin içeren kemoterapi esnasında veya sonrasında, ya da platin içeren neoadjuvan veya adjuvan kemoterapi tedavisini takiben 12 ay içerisinde progrese olan lokal ileri evre veya metastatik ürotelyal karsinomlu hastaların tedavisinde monoterapi olarak progresyona kadar kullanımda endikedir.
Skuamöz Hücreli Baş Boyun Karsinomu (SHBBK)
KEYTRUDA, monoterapi olarak veya platin ve 5-florourasil (5-FU) kemoterapisi ile kombinasyon halinde, ECOG PS 0-1 olan, tümörleri kombine pozitif skor (CPS) ≥ 1 ile PD- L1 eksprese eden erişkinlerde metastatik veya rezeke edilemeyen tekrarlayan nazofarinks dışı SHBBK’nin birinci basamak tedavisinde endikedir. Hastalar eğer küratif kemoradyoterapi almışlarsa küratif tedaviden sonra en az 6 aylık hastalıksız süre geçmiş olmalıdır.
Klasik Hodgkin Lenfoma (cHL)
KEYTRUDA, otolog kök hücre nakli (OKHN) sonrasında relaps olan veya OKHN için uygun olmayan en az iki basamak tedaviyi takiben nükseden veya refrakter, cHL’li 3 yaş ve üzeri pediyatrik ve yetişkin hastaların tedavisinde monoterapi olarak endikedir.
Kolorektal Kanser (mCRC)
KEYTRUDA, monoterapi olarak tümörde mikrosatellit instabilitesi yüksek (MSI-H) veya uyumsuzluk onarım eksikliği (dMMR) bulunan RAS yabanıl (wild) tip, ECOG PS 0-1 olan, erişkin metastatik kolorektal kanserde progresyona dek veya en fazla 35 siklus olarak birinci basamak tedavisinde endikedir. Hastalar eğer adjuvan tedavi almışlarsa 6 aydan uzun hastalıksız süre geçmiş olmalıdır.
Üçlü Negatif Meme Kanseri (TNBC)
KEYTRUDA, valide edilmiş bir test ile PD-L1 (+) (CPS ≥ 10) olan, rezeke edilemeyen lokal olarak tekrarlamış veya metastatik TNBC’nin birinci basamak tedavisinde kemoterapi ile kombine olarak endikedir. Hastalar eğer erken evrede adjuvan kemoterapi almışlarsa en az 6 aylık hastalıksız süre geçmiş olmalıdır.
Mikrosatellit İnstabilitesi Yüksek (MSI-H) Veya Uyumsuzluk Onarım Eksikliği (dMMR) İzlenen Solid Tümörlü Kanser
KEYTRUDA, önceki tedaviyi takiben progresyon gösteren ve alternatif tedavi seçenekleri olmayan, rezeke edilemeyen veya metastatik, MSI-H veya dMMR izlenen solid tümörlü yetişkin hastaların tedavisinde endikedir.
Keytruda dozu, uygulama süresi ve tekniği nasıldır?
Keytruda'nın 3 haftada bir dozu 200 mg veya 2 mg/kg ; 6 haftada bir dozu ise 400 mg’dır. Bu döngülere kür denir. Bu kürler genel olarak ilaç işe yaramayana kadar, kabul edilemez bir yan etki gözlenene kadar veya kanserde ilerleme gözlenmemiş ise 24 aya kadar sürdürülür.
Sadece melanom tanılı hastaların adjuvan tedavisinde kabul edilemez yan etki ve kanserde nüks olmadığı sürece tedavi 12 aya kadar sürdürülür, metastatik veya cerrahi olarak çıkarılamayan melonomlu hastalarda ise ilaç işe yaramayana kadar veya kabul edilemez bir yan etki gözlenene kadar tedavi sürdürülür.
Keytruda her kürün birinci günü en az 30 dakika boyunca intravenöz infüzyon (toplardamar içine) şeklinde uygulanır. Keytruda’nın uygulama süresi kanser klinik araştırmalarına dayanmaktadır ancak doktor tercihine veya hastanın toleransına göre de değişebilir. Kortikosteroid, antihistaminik veya hidrasyon (sıvı desteği) gibi premedikasyon denilen ön ilaçlar verilmesi veya kemoterapi gibi eş zamanlı uygulanması gereken ilaçlar var ise toplam tedavi süreniz artabilir.
Keytruda genellikle günübirlik ayakta tedavi merkezlerinde uygulanır ve tedavinizin sonunda eve gitmenize izin verir.
Keytruda yan etkileri nelerdir?
İshal, bulantı, kaşıntı, deri döküntüsü, yorgunluk hissi, eklem ağrısı, kırmızı kan hücrelerinin sayısında azalma, tiroid bezi sorunları, sıcak basması, iştah azalması, baş ağrısı, baş dönmesi, tat duyumunda değişiklik, akciğer iltihabı, nefes darlığı, öksürük, barsak iltihabı, ağız kuruluğu, mide ağrısı, kabızlık, kusma, deride kırmızı kabarık içi sıvı dolu olabilen döküntüler, deride renk kaybına uğramış bölgeler, kas ağrısı, kaslarda sızlama veya hassasiyet, kaslarda ve kemiklerde ağrı, kollarda veya bacaklarda ağrı, eklemde ağrı ve şişlik, şişlik, olağandışı yorgunluk veya güçsüzlük, ateş, kanda karaciğer enzim düzeylerinde artış, anormal böbrek fonksiyon testi, ilacın infüzyonundan kaynaklanan reaksiyondır.
Aşağıdaki grafikte, immünoterapilerin en sık görülen yan etkilerinin ortaya çıkış ve sonlanma zamanları görülebilir:

Ne sıklıkla izleme gerekli?
Kan testleri, tedaviden önce yapılmalı ve ardından Keytruda tedavisine devam edildiği sürece periyodik olarak kontrol edilmelidir. Kan testleri genellikle tam kan sayımı, kapsamlı metabolik panel, tiroid fonksiyonlarını içermektedir. Bunlara ek olarak doktorunuzun isteyebileceği tetkikler olabilir.
Görüntüleme ne sıklıkla gereklidir?
Görüntüleme Keytruda tedavisine başlamadan önce ve ardından periyodik olarak doktorunuzun önerisine göre yapılmalıdır.
Görüntüleme X ışınları, manyetik rezonans görüntüleme (MRI), bilgisayarlı tomografi (CT) taramaları veya pozitron emisyon tomografisi (PET) taramalarını içerebilir.
Kan testi sonuçları / görüntüleme tedaviyi nasıl etkileyebilir?
Sonuçlara bağlı olarak, doktorunuz Keytruda tedavinize planlandığı gibi devam edebilir, tedavinizi erteleyebilir, tedaviyi değiştirebilir veya tedavinizi sonlandırabilir.
Keytruda kullanırken dikkat edilmesi gerekenler
- Keytruda tedavisi sırasında ciddi bağışıklık sistemi reaksiyonları meydana gelebilir. Bütün organları etkileyebildiği gibi etkilenen en yaygın organlar akciğerler, bağırsaklar, karaciğer, tiroid, böbrekler ve hipofiz bezidir. Bağışıklık sistemi reaksiyonları meydana gelirse, kortikosteroidler verilebilir ve Keytruda tedavisinin ertelenmesi veya kesilmesi gerekebilir.
- Melanom için Keytruda tedavisi gören her 4 kişiden 1'inde vitiligo (cilt hastalığı) görülebilir. Vitiligo genellikle tedavinin başlangıcından yaklaşık 126 gün sonra görülebilir. Bu süre 52-453 gün arasında değişebilir.
- İlaç etkileşimlerini önlemek için Keytruda tedaviniz haricinde kullandığınız herhangi bir ilaç var ise mutlaka doktorunuz veya eczacınıza bildiriniz.






