Sınırlı Evre Küçük Hücreli Akciğer Kanseri için Durvalumab FDA Onayı Aldı
4 Aralık 2024 tarihinde, ABD Gıda ve İlaç Dairesi (FDA), sınırlı evre küçük hücreli akciğer kanseri (SE-KHAK) olan ve platin bazlı kemoterapi ile radyoterapi sonrası hastalığı ilerlemeyen yetişkinler için durvalumab (Imfinzi, AstraZeneca) immünoterapisini onayladı. Bu onay, SE-KHAK hastaları için yeni bir tedavi seçeneği sunarak önemli bir kilometre taşı olarak kabul edilmektedir.
ADRIATIC Çalışması ile Gelen FDA Onayı
Durvalumab’ın etkinliği ve güvenliği, ADRIATIC adlı randomize, çift kör, plasebo kontrollü bir çalışmada değerlendirildi. Çalışmaya, eş zamanlı platin bazlı kemoterapi ve radyoterapi sonrası hastalığı ilerlemeyen 730 SE-KHAK hastası dahil edildi. Hastalar, durvalumab tek başına, durvalumab ile tremelimumab kombinasyonu veya plasebo gruplarına 1:1:1 oranında randomize edildi.
Genel Sağkalım (OS) ve Hastalıksız Sağkalım (PFS) Sonuçları
Durvalumab tek başına uygulanan hasta grubu ile plasebo grubu karşılaştırıldığında, aşağıdaki sonuçlar elde edilmiştir:
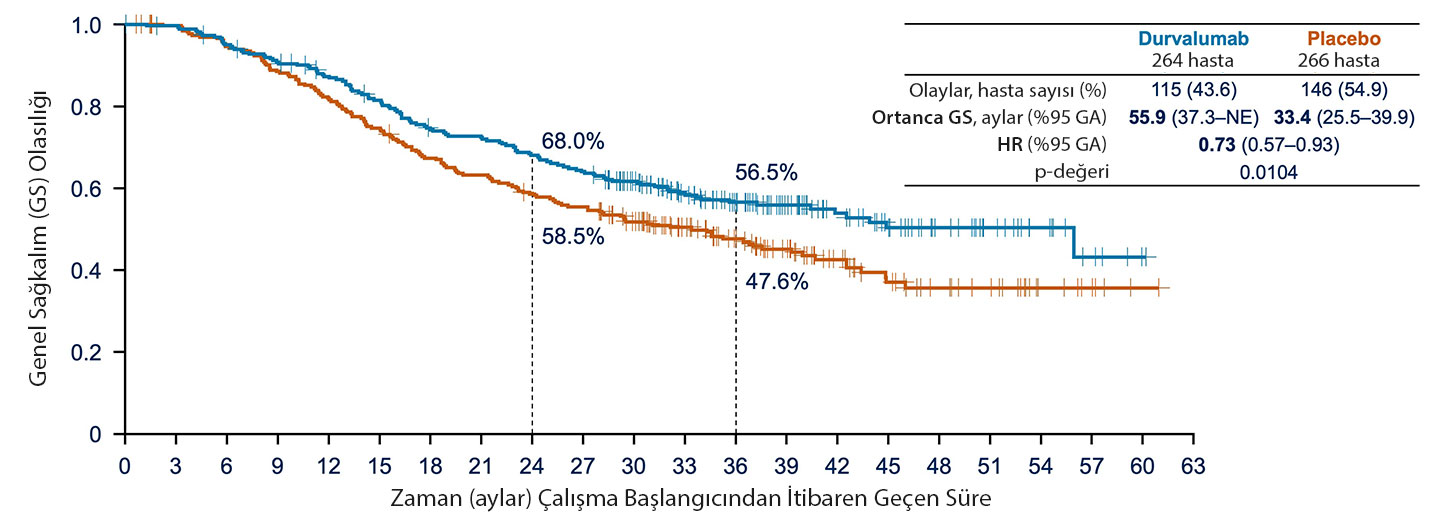
- Genel Sağkalım (OS): Durvalumab, plaseboya kıyasla istatistiksel olarak anlamlı bir genel sağkalım iyileşmesi sağladı (HR: 0,73; %95 CI: 0,57, 0,93; p=0,0104). Durvalumab grubunda median OS, 55,9 ay (%95 CI: 37,3, ulaşılamadı) olarak rapor edilirken, plasebo grubunda bu süre 33,4 ay (%95 CI: 25,5, 39,9) idi.
- Hastalıksız Sağkalım (PFS): Durvalumab, plaseboya kıyasla istatistiksel olarak anlamlı bir PFS iyileşmesi sağladı (HR: 0,76; %95 CI: 0,61, 0,95; p=0,0161). Median PFS, durvalumab grubunda 16,6 ay (%95 CI: 10,2, 28,2) iken, plasebo grubunda 9,2 ay (%95 CI: 7,4, 12,9) olarak rapor edildi.
Yan Etkiler
Durvalumab tedavisi sırasında en sık görülen yan etkiler (%20 ve üzeri) arasında pnömonit veya radyasyon pnömoniti ve yorgunluk bulunmaktadır. Bu durum, tedavinin güvenlik profiline dikkat edilmesini gerektirmektedir.
Önerilen Tedavi Rejimi
- 30 kg ve üzeri vücut ağırlığına sahip hastalar: Her 4 haftada bir 1.500 mg intravenöz infüzyon.
- 30 kg’dan az vücut ağırlığına sahip hastalar: Her 4 haftada bir 20 mg/kg intravenöz infüzyon.
Tedavi, hastalık progresyonu veya kabul edilemez toksisite gelişene kadar, maksimum 24 ay boyunca uygulanabilir.
Küresel Perspektif: Project Orbis ve Uluslararası İş Birliği
Bu inceleme, FDA Onkoloji Mükemmeliyet Merkezi'nin bir girişimi olan Project Orbis çerçevesinde gerçekleştirilmiştir. Project Orbis, onkoloji ilaçlarının uluslararası ortaklar arasında eş zamanlı başvuru ve değerlendirilmesine olanak tanır. Bu inceleme sırasında FDA, Avustralya Terapötik Ürünler İdaresi (TGA), Brezilya Sağlık Düzenleme Kurumu (ANVISA), Kanada Sağlık Bakanlığı ve İsviçre’nin Swissmedic (SMC) ile iş birliği yaptı. Avrupa İlaç Ajansı (EMA) ise bu incelemede resmi bir gözlemciydi. Diğer düzenleyici kurumlarda başvuruların değerlendirilmesi halen devam etmektedir.
Sonuç ve Gelecek Perspektifler
Durvalumab’ın SE-KHAK tedavisindeki onayı, bu agresif kanser türü için tedavi seçeneklerini genişleten ve hastaların yaşam sürelerini önemli ölçüde iyileştiren bir adımı temsil etmektedir. Özellikle genel sağkalım süresindeki belirgin artış, tedavinin etkisini vurgularken, yan etki profili tedavinin uygulanmasında dikkat edilmesi gereken noktaları işaret etmektedir. Bu onay, SE-KHAK hastaları için gelecekteki hedefe yönelik ve immünoterapilere yönelik umutları artırmaktadır.
FDA approves durvalumab for limited-stage small cell lung cancer. 12/04/24. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-durvalumab-limited-stage-small-cell-lung-cancer