Tenosinovyal Dev Hücreli Tümör Tedavisinde Vimseltinib FDA Onayı Aldı
14 Şubat 2025 tarihinde ABD Gıda ve İlaç Dairesi (FDA), yetişkin hastalarda belirti veren tenosinovyal dev hücreli tümör (TGCT: tenosynovial giant cell tumor) tedavisi için vimseltinib (Romvimza, Deciphera Pharmaceuticals, LLC) adlı kinaz inhibitörünü onayladı. Bu ilaç, ameliyatla tümörün çıkarılmasının fonksiyonel kısıtlılığı artırabileceği veya ciddi ek sorunlara yol açabileceği durumlar için geliştirildi.
Vimseltinib: TGCT Tedavisinde İkinci FDA Onayı
Koloni uyarıcı faktör 1 reseptörü (CSF1R) inhibitörü olan vimseltinib, 2019 yılında onaylanan pexidartinib (Turalio, Daiichi) sonrasında ABD pazarında bu endikasyon için onay alan ikinci ilaç oldu. Ayrıca, Merck tarafından geliştirilen üçüncü bir CSF1R inhibitörü de klinik geliştirme aşamasında bulunuyor.
TGCT: Nedir ve Neden Önemlidir?
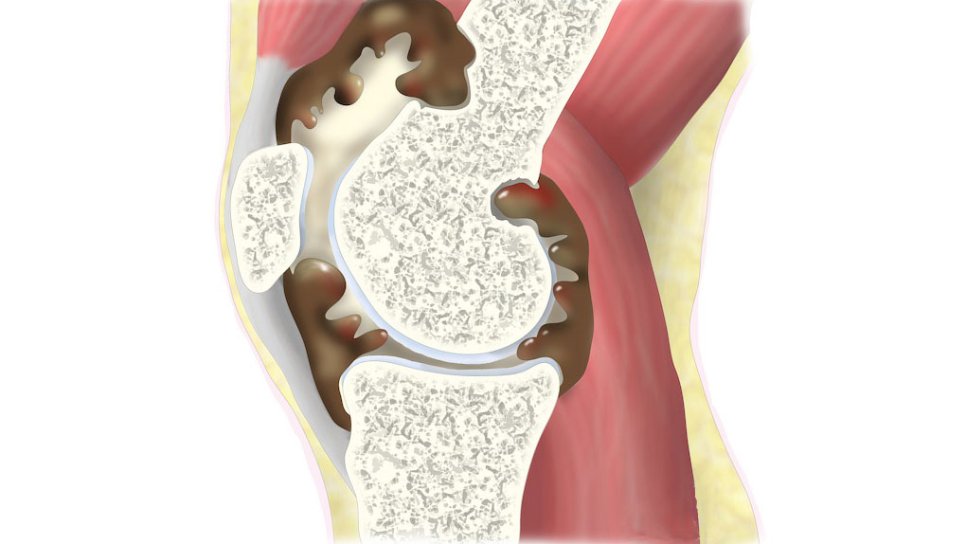
Tenosinovyal dev hücreli tümör (TGCT), eklemleri, bursa yapılarını ve tendonları çevreleyen sinoviyal membranda gelişen, malign olmayan (iyi huylu) bir tümördür. ABD'de yıllık görülme sıklığı milyon başına 1 ila 2 vaka olarak tahmin edilmektedir. TGCT tedavisinde cerrahi genellikle ilk tercih edilen yöntemdir.
Bu hastalık, CSF1 geninin düzensiz çalışması sonucu aşırı CSF1 üretimiyle ortaya çıkar. Bu durum, sinovyumda CSF1-pozitif makrofajların birikmesine neden olur. Hem vimseltinib hem de pexidartinib, CSF1 sinyal yolunu bloke ederek bu süreci engellemeyi amaçlamaktadır.
MOTION Çalışması ile Gelen FDA Onayı
Vimseltinibin etkinliği, MOTION (NCT05059262) adlı çift kör, çok merkezli, randomize (2:1 oranında), plasebo kontrollü bir klinik çalışmada değerlendirildi.
Çalışmaya, cerrahi rezeksiyonun fonksiyonel kısıtlılığı artırabileceği veya ciddi morbiditeye yol açabileceği TGCT hastaları dahil edildi.
Katılımcıların tümörleri RECIST v1.1 kriterlerine göre ölçülebilir olmalı ve en az bir lezyonun 2 cm veya daha büyük olması gerekiyordu.
Hastalar, 24 hafta boyunca haftada iki kez 30 mg vimseltinib veya plasebo almak üzere randomize edildi.
Çalışma iki aşamadan oluşuyordu:
- Çift kör dönem ve
- Açık etiketli dönem
Açık etiketli dönemde, vimseltinib kullanmaya devam eden hastaların yanı sıra, plasebo alan hastalar da vimseltinib tedavisine geçiş yapabildi.
Randomizasyon, tümörün yerleşim bölgesine (alt ekstremite veya diğer bölgeler) ve coğrafi konuma (ABD ve diğer ülkeler) göre yapıldı.
Toplamda 123 hasta çalışmaya dahil edildi: 83 hasta vimseltinib koluna, 40 hasta ise plasebo koluna atandı.
Çalışma Sonuçları
Ana etkinlik ölçütü, 25. haftada kör bağımsız radyolojik incelemeyle değerlendirilen genel yanıt oranı idi. Sonuçlar şu şekilde oldu:
- Vimseltinib kolunda genel yanıt oranı %40 (95% CI: %29, %51)
- Plasebo kolunda %0 (95% CI: %0, %9) (p<0.0001)
Vimseltinib kolunda ortanca yanıt süresine henüz ulaşılmadı. Ek 6 aylık takip sürecinde, yanıt veren 28 hastanın (%85) yanıt süresi en az 6 ay sürdü ve 19 hastada (%58) bu süre 9 ayı aştı.
Ayrıca, vimseltinib alan hastalarda, 25. haftada plaseboya kıyasla aktif hareket açıklığında, hasta tarafından bildirilen fiziksel işlevlerde ve ağrı skorlarında istatistiksel olarak anlamlı iyileşmeler gözlemlendi.
Yan Etkiler ve Kullanım Talimatları
En sık görülen yan etkiler (%20 ve üzeri) şunlardı:
- Laboratuvar anormallikleri: Aspartat aminotransferaz (AST) artışı, alanin aminotransferaz (ALT) artışı, kolesterol artışı, nötrofillerin azalması, lökositlerin azalması
- Klinik semptomlar: Periorbital ödem, yorgunluk, döküntü, periferik ödem, yüz ödemi, kaşıntı
Önerilen vimseltinib dozu, 72 saatlik aralarla haftada iki kez 30 mg oral tablet olarak belirlendi.
Sonuç ve Klinik Önemi
Vimseltinib, tenosinovyal dev hücreli tümör (TGCT) tedavisinde cerrahiye uygun olmayan veya cerrahinin ciddi komplikasyonlara yol açabileceği hastalar için önemli bir tedavi seçeneği olarak onay aldı. Klinik çalışmalarda elde edilen veriler, ilacın hastalarda objektif yanıt oranını artırdığını ve yaşam kalitesinde belirgin iyileşmeler sağladığını gösterdi.
Bununla birlikte, ilacın uzun dönem etkinliği ve güvenlik profili hakkında daha fazla veri elde edilmesi için ileri takip çalışmaları önem taşımaktadır. Vimseltinib, CSF1R inhibitörleri arasında cerrahiye alternatif bir tedavi olarak yeni bir seçenek sunmaktadır.
FDA approves vimseltinib for symptomatic tenosynovial giant cell tumor. 14 Feb 2025. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-vimseltinib-symptomatic-tenosynovial-giant-cell-tumor