
Yaşlanan mikroçevre, kanser oluşumunu ve ilerlemesini nasıl destekler?
Tümör mikroçevresi nedir?
Tümör mikroçevresi (Tumor Microenvironment = TME), tümör dokusunun beslendiği çevre anlamına gelmektedir. Yani tümöre yakın doku olarak tanımlanabilir. Tümör mikroçevresi; kan damarları, bağışıklık sistemi hücreleri, fibroblastlar, hücre dışı matriks, sitokinler gibi pek çok elemanı içeren karmaşık bir ekosistemdir.
Tümör mikroçevresi; doku mimarisi, yangısal tepkimeler, oksijen ve pH seviyesi, hücrelerin beslenme durumu ve doku sıkılığı gibi birçok açıdan normal doku çevresinden (Normal Tissue Environment – NTE) farklıdır.
Normal doku çevresi, tümör oluşumunun erken evrelerinde kanserin büyümesini baskılayabilirken, tümör mikroçevresi, bazı anti-kanser etkilere sahip olabilmesine karşın, genel olarak kanserin büyümesini teşvik eder. Tümör mikroçevresi özellikle kanser büyümesinin temelinde yer alan kanser kök hücrelerinin üretimi ve korunmasında önemli bir rol oynar.
Bu nedenle, tümör mikroçevresinin normal dokuya çevrilmesi, yani tümör mikroçevresinin normalleştirilmesi, kanser büyümesini engelleyebilir veya kansere karşı kullandığımız tedavilerin başarısını artırabilir.
Yaşlanan tümör mikroçevresi
Nature isimli öncü bilim dergisinde yayımlanan bir makalede, yaşlanan mikroçevrenin tümör ilerlemesini nasıl etkileyebileceği derlenmiştir. Özel olarak yaşlanma sırasında kanserli olmayan hücrelerde, hücresel ve moleküler düzeyde ne gibi değişiklikler meydana geldiği ve bunların tümör oluşumuna izin veren bir mikroçevreye nasıl katkıda bulunabileceği değerlendirilmiştir.
Bir yaşlılık hastalığı olarak kanser
Tüm kanserlerin %65’i, 65 yaşın üzerindeki bireylerde ortaya çıkmaktadır. 60-79 yaş aralığındaki hem erkek hem kadınların bir numaralı ölüm nedeni kanserdir. Bu istatistiklerle birlikte, gelişen teknolojinin de getirisiyle uzun ömür beklentisi sağlık hizmetlerinde iyileştirmeler gerektirecektir. Dünya Sağlık Örgütü (DSÖ), 60 yaş üzeri toplam dünya nüfusunun 2050 yılına kadar % 12’den % 22’ye çıkacağını ve bu rakamın 2 milyarı geçeceğini tahmin etmektedir. Bu gerçeğin toplum üzerindeki ekonomik, sağlık ve finansal yükleri önemsiz olmaktan çok uzaktır.
İnsan kanserlerinin mutasyonlar sebebiyle genetik bir hastalık olduğu yaygın olarak kabul edilmektedir. Bununla birlikte, biyolojik evrim de mutasyonlara dayanmaktadır ve kanserler aslında insan evriminin doğal ürünleri-sonuçlarıdır. İnsan evrimi pahasına kanserlerin tamamen ortadan kaldırılması imkansızdır. İşte tam bu nedenden ötürü, oldukça kalabalık bir hastalıklar grubu olan kanseri nasıl öldüreceğimizi değil, nasıl kontrol altında tutabileceğimizi öğrenmemiz gerekir.
Yaşlanma ve kanser oluşumunda, birçok biyolojik süreç benzerdir
Hem kanser hem de yaşlanma mekanizmaları, zamana bağlı hücresel hasar birikiminin temelini oluşturmaktadır. Ayrıca hücresel tabanda yapılan çalışmalar yaşlanmanın ayırt edici özelliklerinin çoğunun kanserle paylaşıldığını ortaya koymaktadır. Bununla birlikte önemli bir ayırt edici özellik olarak birçok çalışma yaşlanmanın, tümör ilerlemesini ve metastazını teşvik eden tümör mikroçevresinin hücrelerini önemli ölçüde etkileyebileceğini göstermektedir. Fibroblastlar (bağ dokunun temel hücreleri) ve bağışıklık sistemi hücreleri, yaşa bağlı bu etkiye özellikle duyarlı görünmektedir. Yaşlandıkça maruz kaldığımız ultraviyole (UV) radyasyon, alkol, sigara ve kirlilik gibi çevresel faktörler, DNA hasarının uzun süreli birikimine ve hücresel yaşlanmayla ilgili diğer olaylara katkıda bulunur. Yaşlanmayla birlikte doku ve hücrelerdeki bozunum özellikleri ve bunlara bağlı olarak kanser riskinin arttığı iyi belgelenmiş durumlardır. Yakın tarihli çalışmalarda, yaşlı bir mikroçevre ile tümör başlangıcı-ilerlemesi arasındaki karmaşık ilişki mekanik olarak ilişkilendirilmeye başlandı. Ayrıca, bir tümör mikroçevresi içerisinde stromanın (ana hücre kümesini çevreleyerek ona destek sağlayan bağ dokusu kitlesi) yaşa bağlı yeniden programlanması da metastatik ilerleyişin önemli bir nedenidir. İlginç bir şekilde farklı kanser türlerinde yaş ve hastalık sonuçlarına ilişkin çelişkili istatistikler bildirilmiştir. Yine yaşlanan tümör mikroçevresi, tümör hücrelerinin kemoterapiye, hedefe yönelik tedavilere ve immünoterapilere verdiği yanıtları etkilemektedir.
Yaşlanan destek doku – evin iskeleti yaşlanınca…
Stroma (destek doku) içerisindeki denge, dokunun kendi dengesinde önemli rol oynamaktadır ve stroma; fibroblastlar, endotel hücreleri, perisitler, adipositler, hücre dışı matriks (ExtraCellular Matrix = ECM) ve bağışıklık hücreleri dahil olmak üzere çeşitli bileşenlerden meydana gelir. Bağ dokunun temel hücreleri olan fibroblastlar, vücut dokularındaki en yaygın stromal bileşendir; bu hücreler, kollajen dahil hücre dışı matriksin sentezi ve bağ dokunun yapısal bütünlüğü için gereklidir ve ayrıca yara iyileşmesi ve iltihaplanmada önemli rol oynamaktadır. Bu işlemlerin birçoğunun düzenlenmesindeki baskın etki biçimleri, birtakım çözünür faktörlerin mikroçevreye salgılanması sonucu kendini gösterir. Yaşlanma sırasında meydana gelen değişiklikler organ bölümleri arasında farklılık göstermektedir, bununla birlikte fibroblastlar da yaşlanır.

"İyi genler" nasıl "kötü genlere" dönüşüyor? Yaşlanan stromal ortamlarda antagonistik pleitropi
Antagonistik pleitropi; bir genin hayatın erken dönemlerinde yararlı etkileri olurken ilerleyen zamanlarında zararlı etkilerinin ortaya çıkması anlamına gelmektedir. Yaşlanma, antagonistik pleitropinin klasik bir örneğidir ve yaşlandıkça hücreler birikmektedir. İnsanlarda yaşlanmanın başlatıcısı doğrudan yaştan mı yoksa diğer faktörlerden mi kaynaklanıyor sorusunun cevabını vermek imkânsız olsa da temel olarak bildiğimiz şey yaşlanan hücrelerin stromal mikro ortamlarda ve doku içerisinde birikmesidir. Yaşlı hücrelerin nasıl biriktiği konusunda hâlâ tartışmalar bulunsa da en önemli düşünce, yaşlandıkça bağışıklık fonksiyonundaki azalmanın bu büyüme ile durdurulan hücrelerin tanınmasını ve temizlenmesini azalttığı ve bunun sonucunda birikmelerine neden olduğudur.
Hücre dışı matriks ve yaşlanma
Salgılanan faktörlere ek olarak fibroblastlar, hücre dışı matriksin (ExtraCellular Matrix = ECM) döşenmesinde de rol alır. ECM dokuların çoğunun mimari bütünlüğünden sorumludur ve vücuttaki protein ve hücreye özgü alışverişi sağlar. Bununla birlikte bu matriks son derece dinamiktir ve bozulma - birikme arasındaki hassas dengeyi kontrol ederken sürekli olarak yeniden biçimlenmektedir. ECM bütünlüğünün kaybı ise kanserin ayırt edici özelliklerinden biridir ve düzensizliği tümör ilerlemesi ve metastazı ile büyük ölçüde ilişkilidir.
Hücre dışı matriks bileşenlerinin organlar arasındaki çeşitliliği
Organlar arasındaki ECM mikro ortamı, özelleşmiş organ yapısı ve işlevi için gereken karmaşık çeşitlilik nedeniyle büyük ölçüde farklılık gösterir ve yaşlandıkça bu faktörler önemli derecede değişir. Sağlıklı bireylerde, beyin ve meme gibi daha yumuşak dokular daha elastik ve daha gevşek bir bağ dokusu ortamına ihtiyaç duyarken, cilt ve kemik gibi daha sert dokular koruyucu bir bariyer sağlamak için daha sert yapılara ihtiyaç duyar. Bu, ECM bileşenlerinin çapraz bağlanması ve toplam kollajen yoğunluğunun düzenlenmesi yoluyla elde edilir. Örneğin deride kollajen ve elastin, sepet örgüsü deseninde hyaluronik asit (HA) yardımı ile birbirine sıkıca bağlanır. HA değişikliklerinin fibroblastların elastin ve kollajen matrikslerini büzme kabiliyetini arttırdığı gösterilmiştir. Ayrıca, HA'nın kanserdeki rolünün dokuya özgü olduğuna inanılmaktadır; azalmış HA, cilt gibi normal olarak HA bakımından zengin dokularda artan tümör oluşumu ile ilişkilidir. ECM sertliğindeki değişiklikler, hücrelerin şeklini büyük ölçüde değiştirebilen biyofiziksel etkilere de sahiptir.
Yaşlanma ve kanserde hücre dışı matriks
Yaşlandıkça ECM bütünlüğünün önemli ölçüde azaldığı açıkça ortaya koyulmuştur. Bunun en iyi bilinen ve aslında en gözle görülebilir örneği, ciltte oluşan kırışıklıklardır. Genç ve yaşlı sağlıklı insan fibroblast örnekleri üzerinde yapılan çalışmalar, genç deri fibroblastlarının, yaşlı deri fibroblastları ile karşılaştırıldığında proteoglikanlar, glikoproteinler ve kıkırdak bağlayıcı proteinler dahil olmak üzere daha yüksek seviyelerde ECM bileşenleri salgıladığını ortaya koymuştur. Genç fibroblastlardan en çok salgılanan ECM bileşeni HAPLN1 isimli bir proteindir ve HAPLN1, bir çapraz bağlama proteinidir; başlangıçta sadece tümör hücreleri tarafından salgılanacağı ve tümör hücresi istilasına katkıda bulunduğu düşünülmüştür. Bununla birlikte, HAPLN1'in genç fibroblastlar tarafından salgılandığını ve bu salgının sağlıklı yaşlı insan derisi fibroblastlarından kaybolduğunu görüyoruz – ki bu tümör hücreleri ve fibroblastlar arasında ortaya çıkan karmaşık etkileşimi ortaya koyan bir başka gözlemdir.
Bağışıklık sistemi mikroçevresi ve yaşlanma
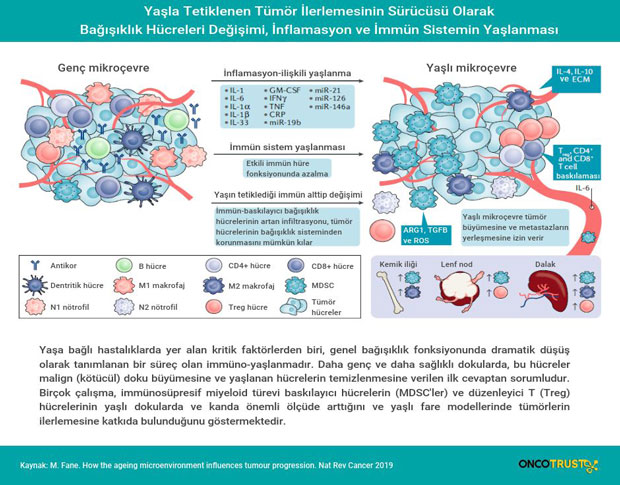
İltihaplanma: Yaşa bağlı kanser ilerlemesinin itici gücü
Bağışıklık sistemi, malign (kötücül) doku büyümesini tanıma ve inhibe etmede (durdurmada) hayati bir rol oynar. Bu nedenle, bağışıklık izleminden kaçınma, tümör başlangıcı - büyümesi ve metastaza doğru ilerlemesi için gerekli kritik bir adımdır. Yaşlanmanın ayırt edici özelliklerinden biri, inflamasyon / iltihaplanma adı verilen bir süreç olan sistemik düşük dereceli kronik inflamasyonda bir artıştır. Bu kalıcı yangısal yanıt, doku dejenerasyonuna ve akut inflamasyonun bozulmasına neden olabilir ve ağırdır. Hücresel yaşlanma, iltihaplanma ile yaşa bağlı birçok maligniteyi ilişkilendiren önemli bir etken olarak değerlendirilmektedir.
Yaşa bağlı immüno-yaşlanma ve kanser
İmmüno-yaşlanma, kanser de dahil olmak üzere yaşa bağlı birçok patolojiye katkıda bulunan başka bir faktördür. Bu, bağışıklık sisteminin yaşa bağlı düzensizliği olarak tanımlanır, böylece bağışıklık hücrelerinin alt birimleri ve genel bağışıklık fonksiyonu azalır. Bu işlem, timik atrofi, naif T hücrelerinde azalmalar, bellek T hücresi işlevinde bir azalma ve T hücreleri tarafından azaltılmış antijen tanıma çeşitliliği dahil olmak üzere birçok faktörün sonucudur. İnflamasyon, bu işlemlerin çoğunun hızlanmasında önemli bir rol oynar gibi görünmektedir, çünkü bu işlemle ilişkili kronik inflamatuar sinyaller ve yanıtlar sıklıkla durdurulmaktadır. T hücresi fonksiyon kaybı ile birlikte, tümör tanıma ve bastırmanın erken döneminde rol oynayan doğal öldürücü hücreler, makrofajlar ve dendritik hücreler, biz yaşlandıkça hücreye toksik şekilde etki edip hücreyi öldüren ya da fonksiyonunu durduran etkilerini yitiriyor gibi görünmektedir.
Nötrofiller yaşlanma boyunca immüno-yaşlanma geçirmiş gibi görünse de, yaşlılarda hala yaralı dokuya sızdığı gösterilmiştir. İlginç bir şekilde çalışmalar yaşlı hastalarda ve farelerde nötrofillerin genç hastalara göre daha fazla anti-inflamatuar protein grubu ürettiğini göstermiştir.
Yaşlanma ve tedaviye yanıt
Yaşlı hastalarda kanser tedavisinde zorlayıcı pek çok durum vardır. Genellikle yaşa bağlı sağlık koşulları klinisyenleri, potansiyel olarak faydalı tedavilerin standart dozajlarda güvenli bir şekilde uygulanıp uygulanamayacağı ve sağ kalımın iyileştirilip iyileştirilmeyeceği veya potansiyel yan etkilerin hastanın yaşam kalitesini etkileyip etkilemeyeceği konusunda bir ikilemde bırakır. Tüm kanserlerin yaklaşık % 50'si, 65 yaşın üzerindeki hastalarda görülmektedir ve bu rakam tahmini olarak yaşam beklentisi artmaya devam ettikçe % 70'e yükselecektir; bununla birlikte bu yaşın üzerindeki hastalarda klinik çalışmalarda son derece sınırlı veri bulunmaktadır. Kanser klinik çalışmalarına katılan hastaların sadece % 40'ı 65 yaş üzerindedir ve % 10'dan azı 75 yaş üzerindedir. Önemli bir detay olarak, klinik öncesi çalışmaların çoğu 6-8 haftalık farelerde tasarlanmıştır ve bu çoğu kanser hastalarında ortaya çıkan gerçek klinik yaşı büyük ölçüde yanlış temsil etmektedir. 18 aylık farelerin yaşlı nüfusu daha iyi temsil ettiği, insanlarda 60 yaşına eşit olduğu düşünülmektedir; ancak bu sefer de farklı organlar için farklı yaş aralığını temsil ediyor olabilir. Yaşlı tümör mikroçevresinin altında yatan mekanizmaların anlaşılması ve tedaviye yanıt konusundaki son gelişmeler, yaşlı bireylerde kanserin daha verimli hedeflenmesini sağlayacak önemli bilgileri ortaya çıkarabilir.
Yaşlı hastalarda kemoterapi tedavisine yanıt
Kemoterapi, hızlı büyüyen malign (kötücül) hücrelerin hedeflenmesiyle sonuçlanan spesifik olmayan, agresif bir tedavi yöntemidir. Tek başına veya diğer hedefe yönelik tedavilerle kombinasyon halinde kullanılabilir. Sınırlı özgüllüğü göz önüne alındığında, daha yaşlı bireylerde sıklıkla hayatı tehdit edebilecek tedaviyle ilişkili birçok yan etki vardır. Yaşlı mikroçevrenin kemoterapi ilaçlarına karşı dirence nasıl katkıda bulunabileceğine dair birçok örnek vardır. Yaşlanmış bileşenler, hızla çoğalmacı olmayan doğası nedeniyle kemoterapiye zaten oldukça dirençlidir. Ek olarak bu hücreler, kanser hücrelerinin kemoterapiye içsel direncini destekleyen faktörler salgılayabilir.
Kemoterapinin yaşlı hastalarda immüno-yaşlanmayı daha da hızlandırdığı gösterilmiştir. Bunu, mikro ortamlardaki yaşlanma hızına artırarak yaptığı düşünülmektedir. Yaşlı hastalarda kemoterapinin iyi tolere edildiği ve kanserin konumuna bakılmaksızın sağkalımı uzattığı birçok vaka vardır ve yaşlılarda kemoterapi ilaç tedavi rejimlerinin belirlenmesinde, tedavinin yararlarının yan etkilerden daha ağır olup olmadığı göz önüne alınmalıdır.
Yaşlı hastalarda hedefe yönelik tedavi yanıtı
Hedefe yönelik tedavi, kanser hücrelerini veya tümör mikroçevresini hedeflemeyi amaçlayan kişiselleştirilmiş bakım standardını temsil eder. Tümörleri başlangıçta hedefe yönelik tedaviye yanıt veren birçok hasta olsa da bunların büyük bir kısmı sonradan dirençli hale gelebilmektedir. Hedefe yönelik tedaviye direnç konusunda sinyal yolaklarındaki değişikliklerin mikroçevre ile ilişkisi, özellikle yaş bakımından iyi tanımlanmamıştır. Hedefli tedavinin kemoterapi ve radyoterapiye kıyasla genellikle daha az hedef dışı etkileri vardır ve bu nedenle hücrelerin, dirençli bir tümör çevresini uyarmak için genetik mutasyonlara, epigenetik değişikliklere ve genomik dengesizliğe dayanan daha içsel değişikliklere uğradığı görülmektedir.
Yaşlı hastalarda immünoterapi yanıtı
Tümör hücrelerini hedeflemek ve ortadan kaldırmak için bağışıklık mikro çevresini düzenleyen immünoterapiler, son on yılda kanser tedavisinde devrim yaratmıştır; bununla birlikte bu tedavilere direnç konusu da son derece önemlidir. Yaşlı kanser modellerinde immünoterapilerin etkinliğini değerlendiren az sayıda doğrudan çalışma mevcuttur. Yapılan gözlemler, lenfoma, glioblastoma ve lösemi gibi hastalıklar için yaşlı hastaların immünoterapiye daha az yanıt verebileceğini düşündürmektedir.
Hasta popülasyonları arasındaki genetik ve çevresel çeşitlilik, çeşitli ırksal ve etnik kökenler arasındaki toplu analizleri de sınırlar. Yine de, yaşlı modellerde bir bağışıklık kontrol noktasını hedeflerken görülen tutarsızlık göz önüne alındığında, spesifik bağışıklık hedefli tedavilerin yaşa göre uyarlanması gerekebilir. Ortaya çıkan bu veriler, tüm kanser türlerinde yaşa özel modellere duyulan ihtiyacı vurgulamaktadır. Sonuç olarak, kanserde yaşa bağlı değişikliklerin hedeflenmesinin, bu büyüyen halk sağlığı yükünü hafifletmek için yeni yollar sağlayabileceği açıktır.
Tümör agresifliği her zaman yaşla ilişkili değildir
Birçok tümör tipinde yaş, daha agresif bir tümöre işaret etmektedir. Bununla birlikte, meme ve kolon kanseri gibi bazı kanserler için, yaşlı hastalarda genel görülme sıklığı daha yüksek iken, genç hastalarda teşhis edilen kanserler daha agresiftir ve daha kötü şekilde sonuçlanır. Bu farklılığın nedenleri tam olarak aydınlatılamamıştır fakat şu gibi sebeplerden kaynaklanıyor olabilir:
Kanser taraması eksikliği
Genç bireylerde mamografi ve kolonoskopi gibi rutin taramalar zorunlu değildir. Bu nedenle, genç bireylerde kanserlerin farkedilmesi, rutin ve düzenli tarama ile teşhis edilenlerden çok daha geç olacaktır.
Daha agresif hastalıkları teşvik eden sürücü mutasyonları
Meme kanserinde BRCA1 ve BRCA2; kolorektal kanserde ise APC genlerindeki sürücü mutasyonlar, tümörlerin erken belirtilerini tetikleyebilir ve tümörün alt tipine bağlı olarak, meme ve kolon kanseri olan genç hastalarda tümörler daha agresif seyredebilir.
Hormonal etkiler
Meme kanseri, hormonal etkilere melanom gibi diğer kanserlere göre daha duyarlı olabilir; bu nedenle menstrüasyon sırasındaki dalgalanmalar meme kanserlerinin agresif doğasını etkileyebilir ve menopoz sırasındaki değişiklikler agresifliği biraz azaltabilir. Ek olarak, hamilelik sırasında teşhisi konulan melanomların oldukça agresif olabileceği gösterilmiştir ve son veriler bunun östrojen reseptörlerinin anormal üretiminin ve buna bağlı sinyalleşmenin bir sonucu olduğunu göstermektedir.
Obezite
Obezite, kanser türleri için bir risk faktörüdür ve genç hastalarda obezite oranları hızla artmaktadır. Bu da genç popülasyonda artan kanser oranlarını açıklayabilir. Genç erişkinlerde artan meme ve kolon kanseri gibi hastalıklarda obezite ile ilişkili iltihaplanma süreci, bu kanserlerin agresifliğini artırabilir.
Mitchell Fane and Ashani T. Weeraratna.
How the ageing microenvironment influences tumour progression.
Nature Reviews Cancer, 13 Dec 2019






