İnflamasyon, Yangı, İltihaplanma nedir? Kanserle İlişkisi Nasıldır?
İnflamasyon, enflamasyon, yangı veya halk arasında bilinen adı ile iltihaplanma, kan damarları ile beslenen dokuların, her türdeki hasar karşısında (canlı, cansız yabancı etkene veya içsel/dışsal doku hasarına) verdikleri fizyolojik yanıtların bütünüdür. İnflamasyon, Latince olarak "ateşe vermek" teriminden köken almıştır ve amaç, bağışıklık sistemine ait hücrelerin saldırının olduğu bölgeye çekilip saldırganı yok etmesine imkan vermektir.
Bağışıklık sistemi yanıtı hücresel, humoral (sıvısal) veya vasküler (damarsal) olabilir.
İnflamasyon normalde patolojik bir durum olmasına karşın, inflamatuvar (yangısal) reaksiyon fizyolojik olarak vücudun gösterdiği bir tepkidir. Halk arasında iltihap tabiri yangı için kullanılmasına rağmen sık sık apseler için de iltihap denmesinden dolayı yangı terimini kullanmak daha yerinde olacaktır. Yangı konusu, hastalıkların patolojik temelini oluşturmaktadır.
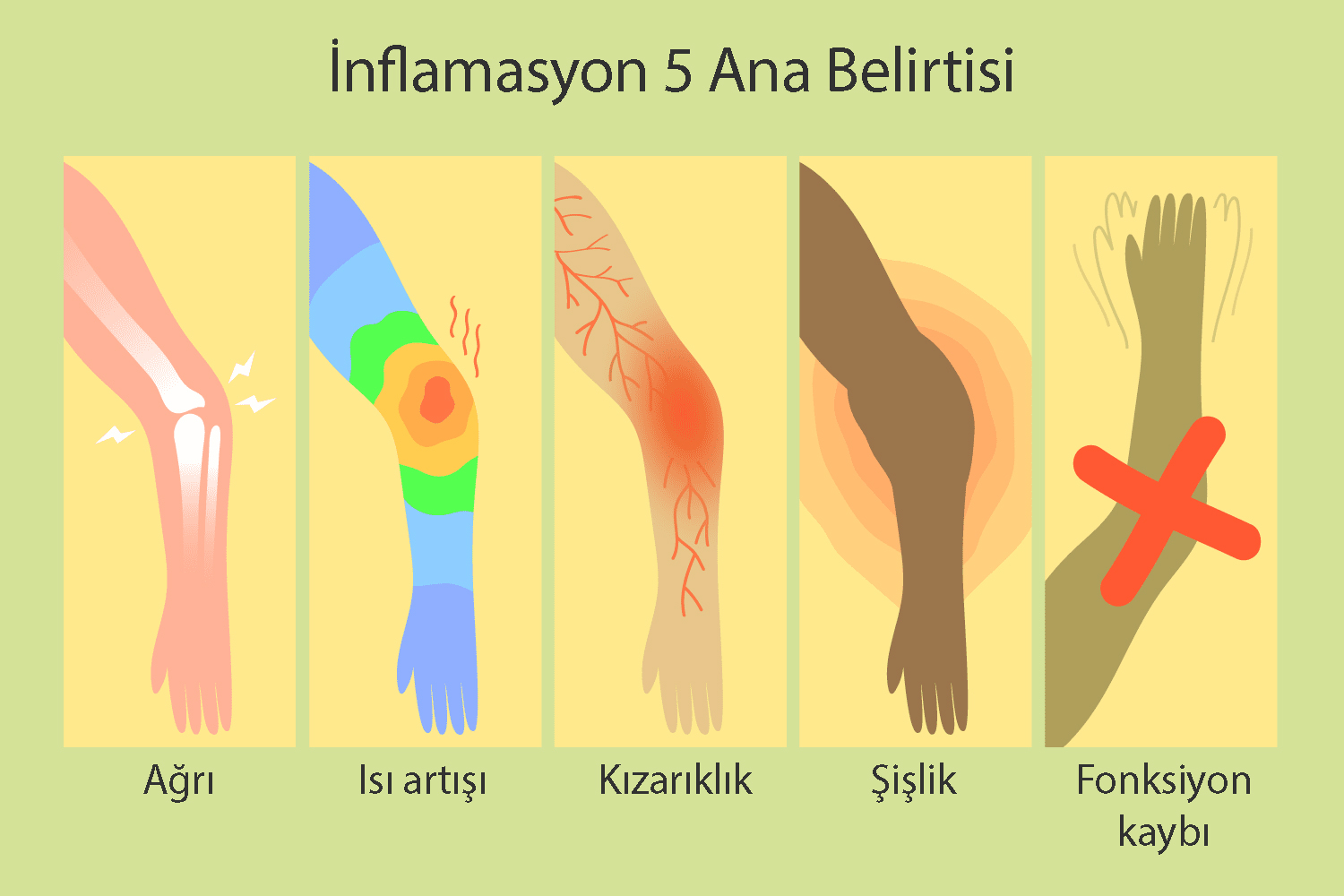
İnflamasyonun Belirtileri
Genel inflamasyonun 5 ana belirtisi bulunmaktadır;
- Kızarıklık
- Ağrı
- Bölgesel ısı artışı
- Şişlik ve
- Fonksiyon kaybı
Kanser ve İnflamasyon
İnflamasyon, aynı zamanda Kanserin 10 Temel Özelliği'nden biri olarak da karşımıza çıkmaktadır. Tümör ortamı sadece kanser hücrelerini barındırmaz, aynı zamanda iltihaplanma ilişkili bağışıklık sistemi hücrelerini de içerir; bu ortama tümör mikroçevresi denir. Bu hücreler büyüme faktörleri ve enzimlerin sayısını artırarak kanserin yeni damar oluşturmasını ve yayılmasını destekleyen bir ortam oluşturur. Aynı zamanda reaktif oksijen radikalleri üreterek DNA’nın hasar görmesine ve kanserleşmeye neden olur.
İnflamasyon, kanser gelişimine zemin hazırlar ve tümör oluşumunun tüm aşamalarını destekler. Kanser hücreleri ve ayrıca çevreleyen bağ doku ve inflamatuvar bağışıklık sistemi hücreleri, hep birlikte inflamatuar bir tümör mikro-çevresi (TMÇ) oluşturmak için iyi organize edilmiş karşılıklı etkileşimlere girerler. TMÇ içindeki hücreler son derece iyi bir plastisiteye sahiptir ve fenotipik ve fonksiyonel özelliklerini sürekli değiştirir. Tümör teşvik eden inflamasyonun moleküler ve hücresel mekanizmalarını yöneten temel kuralların tanımlanması, kanser karşıtı daha etkili tedavilerin geliştirilmesi için gerekli olacaktır.
Ayrıca kanser ile ilişkili inflamasyon, tümör gelişiminin farklı zaman dilimlerinde tetiklenebilir. Bu yüzden inflamasyon ve kanserin rollerini ve etki mekanizmalarının hasara uğratılması için kanserdeki inflamasyonun hem zaman hem de uyaran açısından ilk olarak nasıl tetiklendiğini ve devam ettiğini anlamak önemlidir (Şekil 1).
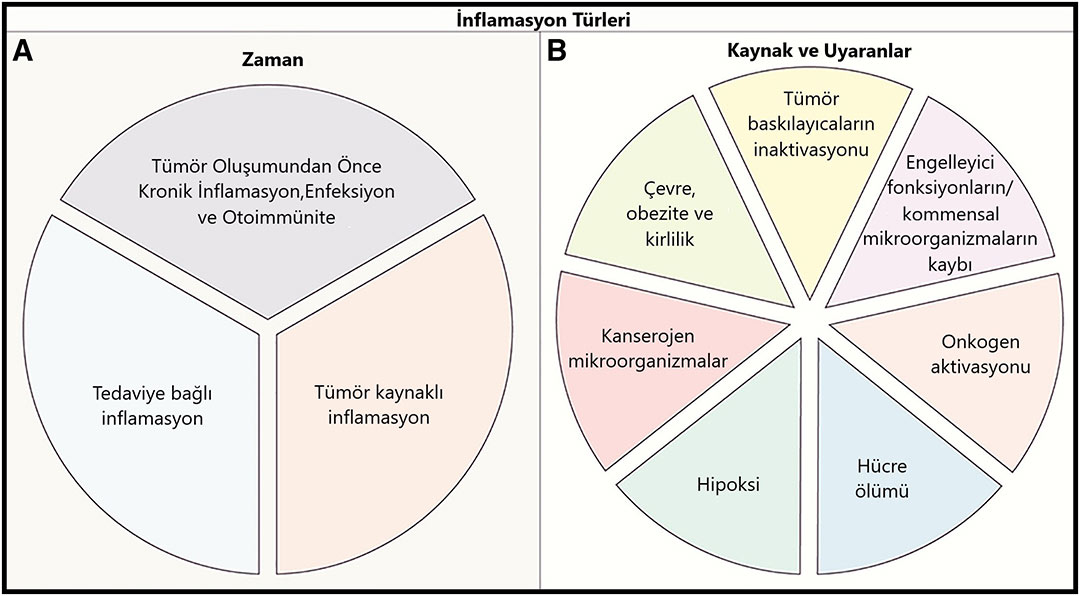
Şekil 1: A) Kanser ile ilişkili inflamasyon, tümör gelişiminin farklı zaman dilimlerinde tetiklenebilir. Otoimmünite veya enfeksiyon şeklinde karsinojenezden önce gelebilir, kanser hücreleri tarafından tetiklenebilir veya anti-kanser tedavisi ile tetiklenebilir. B) Hücre içi, konak hücreye bağlı veya çevresel olmak üzere birçok faktör, farklı tümör türlerinde tümörle ilişkili inflamasyona neden olabilir.
Tümör Oluşumundan Önce Kronik İnflamasyon, Enfeksiyon ve Otoimmünite
Tüm kanser vakalarının yaklaşık olarak %15-20’sinden önce aynı doku veya organ bölgesinde enfeksiyon, kronik inflamasyon veya otoimmünite gelir. Bu gibi durumlarda, kanseri teşvik eden inflamasyon tetiklenir ve bu tümör oluşumundan çok önce meydana gelir.
Ayrıca, bazen düşük dereceli ve şiddetli de olsa, kronik inflamasyonun tetklemesi yoluyla tamamen veya kısmen kansere zemin hazırlayan ve teşvik eden çeşitli çevresel faktörler de vardır. Bu durumda, inflamasyon tümör gelişiminden önce veya tümörle birlikte meydana gelebilir. Konak hücre ile ilişkili olarak, bu faktörler sistemik veya bölgeye ve organa özgü olabilir. Örneğin tütün dumanı, öncelikle akciğer ve solunum yolu inflamasyonuna neden olur ve akciğer kanseri ve mezotelyomayı teşvik eder. Öte yandan obezite ve hipergliseminin (kan şekeri yüksekliği) neden olduğu düşük dereceli inflamasyon genellikle sistemik niteliktedir ve karaciğer, pankreas, kolon (kalın bağırsak) ve meme kanseri dahil olmak üzere birçok farklı kanser riskini artırabilir. Daha önce kanser için bağımsız bir risk faktörü olarak kabul edilen Tip-II diyabet, obeziteye bağlı inflamasyonun ve doku hasarının bir parçası olarak görülebilir.
Tümör Kaynaklı İnflamasyon
Bununla birlikte, kanserlerin çoğunluğu, uzun süredir devam eden kronik inflamasyondan önce gelişmez. Örneğin inflamatuvar bağırsak hastalığı; kolit ile ilişkili kansere zemin hazırlamasına rağmen, kolorektal kanserlerin sadece yaklaşık %2’sinde önceden bağırsak iltihabı vardır. Ek olarak, hayvan deneylerinde inflamatuvar yanıtların baskılanması, görünüşte inflamatuvar olmayan kanserlerde bile, tümör büyümesini ve ilerlemesini engellemiştir.
Daha önce “inflamatuvar olmayan” şeklinde tanımlanan kanserlerin, bağışıklık hücrelerini toplaması ve tümör büyümesini desteklemek ve TMÇ’sini kendi lehine göre yeniden şekillendirmek için inflamatuvar aracıların ekspresyonunu (ifadesini) artırması, "tümör kaynaklı inflamasyon" (TKİ) teriminin ortaya çıkmasına neden olmuştur.
Ancak mikrobiyal açıdan zengin ve steril tümörlerde TKİ tetikleyiciler farklı olabilir. Örneğin kolit ilişkili kanserde tümör oluşumu bölgesinde koruyucu bağırsak bariyerinin onkojen kaynaklı bozulması, IL-23 üretimini ve IL-23’e bağlı TKİ tetiklemek için tümörle ilişkili miyeloid hücreler tarafından tanınan kommensal bakterilerin ve bakteriyel ürünlerin yer değiştirmesine yol açar.
Buna karşılık mukozal yüzeylerle ilişkili olmayan tümörlerde başlangıç inflamatuvar tetikleyici, onkojenik transformasyonun, metabolik değişikliklerin, hücre ölümünün veya hipoksinin hissedilmesinden kaynaklanabilir.
Kanserde Tedaviye Bağlı İnflamasyon
Bir başka inflamasyon türü ise kemoterapi ve radyoterapi dahil olmak üzere çeşitli anti-kanser tedavilerine ve son zamanlarda çeşitli biyolojik tedavilerin veya immünoterapilerin neden olduğu immün infiltrasyona yanıt olarak gelişen tedaviye bağlı inflamasyonlardır. Tedavi sonrasında tümörde bağışıklık sistemi aktivasyonu, mevcut immünoterapilerin temel mantığıdır. Ayrıca bu süreç, standart tedavilerle kombinasyon halinde çalışacak anti-tümör bağışıklık yanıtlarının uyarılması için kesinlikle faydalı olabilir.
Bazı durumlarda, saldırılan ve ölmekte olan tümör hücrelerinden ATP ve Yüksek Mobilite Grubu Protein 1 (High Mobility Group Box 1) gibi hasarla ilişkili moleküler modellerin salınması, IL-1α ve diğer bağışıklık sistemini uyaran sitokinlerin üretimini tetikleyebilir. Bu, tümör neo-antijenlerinin artan salınımı ile birlikte de novo anti-tümör T hücresi tepkilerini itetikleyebilir ve devam ettirebilir veya immünsupresyona (bağışıklık baskılanmasına) yol açabilir. Ancak net sonuç, ilgili sitotoksik rejimlerin veya radyoterapilerin, kanser karşıtı bağışıklık hücrelerinin aktivasyonunu ve işlevini nasıl etkilediğine bağlı olacaktır.
Ayrıca birçok tümör, apoptotik (programlı) hücre ölümünde yetersizdir ve bu nedenle nekroz ile hücre ölümü immün sistem için uyarıcı olabilir. Örneğin tümör hücrelerinin nekroptotik hücre ölümü, ölmekte olan ve kalan tümör hücreleri arasındaki antijenlerde bile lokal ve abskopal anti-tümör bağışıklığını tetikleyebilir.
Önemli olarak birçok durumda, tedaviler ile tümörlerin kısmen yok edilmesi ve ölü hücre maddesinin salınması da immünsupresif etkilere sahip olacaktır. Daha sonra yara iyileşmesi ve doku onarımı ile devam eden normal dokuya verilen hasara benzeyen bir inflamatuvar yanıtı uyaracaktır. Burada ölmekte olan tümör hücrelerinin tanınması, TMÇ hücreleri tarafından sitokinlerin ve büyüme faktörlerinin üretimi ve bu hücrelerin fazladan alımını uyaracaktır. Bu hücre dışından etkili büyüme faktörleri, genel olarak hücre karşıtı ölüm sinyalleri olarak çalışabilir, ki bu da uygulanan tedavinin etkinliğini azaltacaktır.

Kanser kök hücreleri daha az proliferatif ve daha az metabolik olarak aktif olduklarından birçok kemoterapi ve radyoterapi formuna daha az duyarlıdırlar. Miyeloid hücrelerin alımındaki artış ve bunların pirimindin nükleotitlerini salmaları, panreatik kanserlerin gemsitabine karşı direncini sağlar ve bu da inflamatuvar hücrelerin tedavi direncinde immün olmayan, metabolik rolüne örnektir.

Bir başka mekanizma da kemoterapilerin, özellikle bağırsakta normal doku hasarına, inflamatuvar mikrobiyal ürünlerin translokasyonuna ve sistemik inflamasyonun aktivasyonuna neden olmasıdır. Bu da mikrobiyal ürünlerin metastazı hızlandırdığı miyelodisplastik sendromu ve çeşitli metastatik kanserler için tümörleri daha da teşvik etmektedir.
Sonuç olarak, tedaviye bağlı inflamasyon yalnızca tedaviden sonra gelişir ama tedavi etkinliğinin veya tedaviye direncin belirlenmesinde önemli bir rol oynayabilir. Bu bağlamda, tümör gelişimi sırasında inflamasyonu tetikleyen kesin sinyallerin tanımlanması, şüphesizki tümör gelişiminin TMÇ’ni nasıl şekillendirdiğinin daha iyi ve geniş ölçüde anlaşılmasına yardımcı olacaktır.
Tümör Oluşumu Sırasında İnflamasyonun İndüklenmesi İçin Kaynaklar ve Uyaranlar
İlk inflamatuvar yanıtların nasıl indüklenebileceğine ve ilgili nedenler ve uyaranlara ilişkin çeşitli mekanizmalar vardır (Şekil 1B).
Kanserin ayırt edici özelliklerinden biri, hücreye özgü tümör baskılayıcı fonksiyonların kaybıdır. En yaygın mutasyona uğramış tümör baskılayıcılardan biri, p53 proteinini kodlayan Tp53’tür. P53 proteini, hücresel homeostazı düzenlemek için çok yönlü fonksiyonlara sahiptir ve bunlardan biri, inflamasyonun önemli bir pozitif düzenleyicisi olan Nükleer Faktör-κB (NF-κB) ile transkripsiyonel antagonizmidir. NF-κB aktive edici sinyallerin her zaman TMÇ’de ve hatta normal bir dokuda mevcut olduğu göz önüne alındığında, fonksiyonel p53'ün kaybı, NF-κB 'ye bağlı inflamatuvar genlerin ifadesinin artmasına neden olur. Bu da kolorektal kanserde tümörün ilerlemesini ve metastazı artırır. Tümör baskılayıcıların kaybı, uygun DNA onarımını da engelleyebilir ve DNA hasarına bağlı inflamasyon yollarını tetikleyen DNA hasarını hızlandırabilir.
Tümör gelişi ve ilerlemesine başlangıçta HPV (insan papilloma virüsü) gibi bir patojen öncülük ediyorsa, kalıcı patojenlerin tanınması elbette farklı inflamatuvar yanıtları teşvik edecektir. Bu korunmuş moleküler kalıpları tanıyan “klasik” reseptörler aracılığı ile kansere neden olan patojenlerin tanınmasının doğal inflamatıuvar yanıtları tetikleyeceği en basit örneklerden biridir.
Bir başka paradigma ise birçok kanser türünün ya mikroorganizmaların kanser hücrelerine yapışmasına ya da inflamasyonu aktive eden mikrobiyal metabolitlerin uzak salınımı ile kommensal mikrobiyota tarafından tetiklenebilmesidir. Bu mikroorganizmalar ve mikrobiyal ürünler, tümörlerle birlikte metastaz bölgesine bile gidebilir ve metastazda inflamasyon kaynağı olabilirler.
Kanserde inflamasyonun kaynağı ve/veya tetikleyicisi farklı olsa da inflmasyonun tetiklenmesinin her zaman onkojenik süreç için kesinlikle gerekli faktörlerin ortaya çıkmasıyla oldukça ilişkili olduğu görülmektedir – onkogenlerde ve tümör baskılayıcılarda değişiklikler, mikrobiyal kaynaklı kanserler için enfeksiyonlar veya transformasyon kaynaklı doku organizasyonu kaybı nedeni ile engelleyici fonksiyonun bozulması gibi. İnflamasyon, doku homeostazının kaybına verilen yanıtlar sırasında indüklenecek şekilde bağlantılı olduğundan, inflamasyonun indüklenmesi, onkojenik transformasyon için gerekli olan genetik ve transkripsiyonel programlarda ve dolayısıyla birçok koşulda “önceden kodlanmıştır”.
Sonuç Olarak
Kanserde pro-tümörijenik inflamatuvar yolak mekanizmaları üzerine olan çalışmalar, enfeksiyona karşı bağışıklığa aracılık etmek ve doku homeostazını desteklemek için evrilen bu yolakların tümörler tarafından kendi yararlarına yönelik olarak kullandığını ortaya çıkarmıştır. TMÇ’de inflamasyonun indüklenmesi farklı zamanları takip edebilir. Tümör oluşumunun başlamasından önce veya sonrasında meydana gelebilir. Ayrıca metastazın veya tedaviye direncin geç aşamalarına kadar da sessiz kalabilir.
Önemli olarak tümörlerde inflamasyonu indükleyen birkaç farklı uyaran vardır. Karsinojen mikroorganizmalar, çevresel faktörler ve obezite ile ilişkili düşük dereceli inflamasyon ve ayrıca epitelyal engelleyicinin bozulması ile ilişkili kommensal mikroorganizmalar bunlara örnektir.
Doğrudan bağışıklık hücrelerine dayalı çeşitli tedaviler (kontrol noktası immünoterapileri, aşılar ve CAR T hücreleri) dahil olmak üzere modern kanser tedavileri sürekli olarak genişledikçe, tedavi direncinde bağışıklık ve inflamatuvar yolların rolünü ortaya çıkarmak zorunlu olacaktır. Ayrıca inflamasyonun, tümör gelişiminin tüm aşamalarında rol oynayabileceği göz önüne alındığında gelecek araştırmalar, özellikle erken tümör oluşumunda ve metastazda inflamasyon ve bağışıklık hücrelerinin moleküler ve hücresel mekanizmalarını ortaya çıkaracaktır. Bu da birçok kanser türü için hassas tedavilere olanak sağlayacaktır.
Greten, Florian R., and Sergei I. Grivennikov. "Inflammation and cancer: triggers, mechanisms, and consequences." Immunity 51.1 (2019): 27-41.