Yeni Bir Kanser İlacını Geliştirme Maliyeti 1.2 Milyar Dolar!
ABD pazarında yeni bir ilaç geliştirme maliyeti, hem ilaç geliştirme başarısızlıkları hem de sermaye maliyetleri dikkate alındığında, ortalama 879,3 milyon dolar olarak tahmin edilmektedir. Bu bulgular, Türk araştırmacı Dr. Aylin Sertkaya'nın öncülüğünde yapılan ve JAMA Network Open'da 28 Haziran 2024'te yayımlanan bir çalışmada sunulmuştur.
Araştırmanın Temel Bulguları
Ortalama Geliştirme Maliyeti
Yeni bir ilaç geliştirmenin ortalama maliyeti yaklaşık 172,7 milyon dolar olarak tahmin edilmiştir. Bu maliyete pazarlama sonrası çalışmalar da dahildir.
Başarısızlıklar Dahil Maliyet
Başarısızlıkların maliyeti eklendiğinde, beklenen ortalama maliyet 515,8 milyon dolara yükselmiştir.
Sermaye Maliyeti
Beklenen ortalama sermaye maliyeti 879,3 milyon dolar olarak hesaplanmıştır.
Onkoloji Alanındaki Maliyetler
- Ortalama Geliştirme Maliyeti: Onkoloji alanında yeni bir ilaç geliştirmenin ortalama maliyeti 84,7 milyon dolar olarak belirlenmiştir.
- Başarısızlıklar Dahil Maliyet: Başarısızlıklar göz önüne alındığında, beklenen ortalama maliyet 595,5 milyon dolara yükselmiştir.
- Sermaye Maliyeti: Beklenen ortalama sermaye maliyeti 1,2 milyar dolar olarak hesaplanmıştır.
İlgili konu: Hekimlerin Çoğu FDA Onay Sürecini Tam Anlamıyor – Peki Ya Hastalar?
Bir Kanser İlacı için Onay Alma Süreci Nasıldır?
Kanser ilacı geliştirme süreci, oldukça zaman alıcı ve maliyetli bir yolculuktur. Bu yolculuğun her adımı, ilacın potansiyel faydalarını ve risklerini dikkatlice değerlendirerek, hastalar için güvenli ve etkili tedaviler sağlamayı amaçlar. Aşağıda, kanser ilacı geliştirme sürecine dair bazı kısa ve anektodal bilgiler yer almaktadır:
- Süreç Ne Kadar Sürüyor? Kanser ilacının keşfinden FDA onayına kadar olan süreç genellikle 7 ila 15 yıl arasında değişmektedir. Bu süre, ilacın keşfi, preklinik çalışmalar, klinik araştırmalar ve son olarak onay aşamalarını içerir.
- Onay Sürecinde Başarı Oranları: Kanser ilaçlarının FDA tarafından onay alma oranı düşüktür. Klinik denemeye başlayan ilaçların yaklaşık %5-7'si FDA onayı alır. Bu düşük oran, kanser araştırmasının zorluklarını ve yeni tedavilerin güvenliğini ve etkinliğini kanıtlama gerekliliğini yansıtmaktadır.
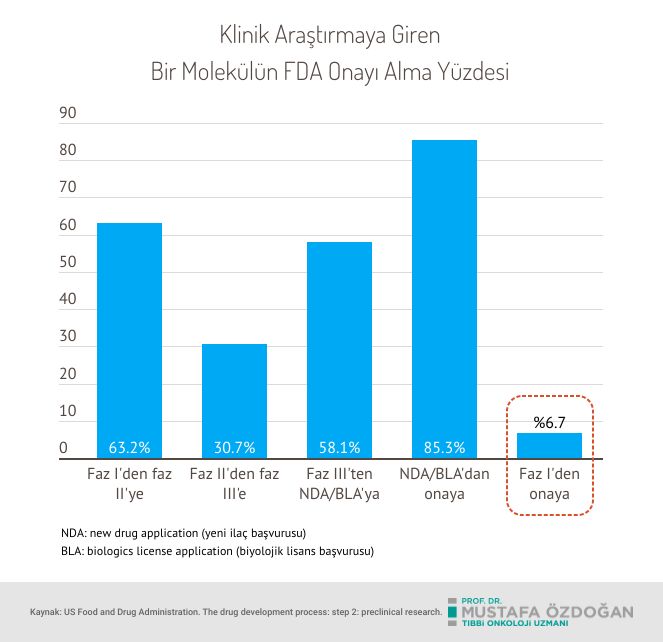
- Hızlandırılmış Onay Yolları: FDA, özellikle ciddi veya yaşamı tehdit eden hastalıklar için tedavileri hızlandırmak amacıyla çeşitli hızlandırılmış onay programları sunmaktadır. Bu programlar, Breakthrough Therapy Designation ve Accelerated Approval gibi yöntemlerle, belirli kriterleri karşılayan ilaçların daha hızlı değerlendirilmesine olanak tanır. Ancak, bu ilaçların piyasaya sürülmesinden sonra da etkinliklerini ve güvenliklerini izlemek için takip çalışmaları gereklidir.
- Klinik Deneyler ve Etkinlik Ölçütleri: Kanser ilacı geliştirme sürecinde, ilacın etkinliğini değerlendirmek için genellikle genel sağkalım oranları veya hastalıksız sağkalım gibi sonuç ölçütleri kullanılır. Ancak, bazı durumlarda surrogate ölçütler (örneğin, tümörün küçülmesi) kullanılarak ilacın potansiyel faydası daha erken bir aşamada değerlendirilebilir.
Bu anektodal bilgiler, kanser ilacı geliştirme sürecinin hem zorluklarını hem de bu sürecin neden titiz bir şekilde yürütülmesi gerektiğinin altını çizer. Her yeni kanser ilacı, onay sürecinden geçerken, bu ilaçların geliştirilmesi ve değerlendirilmesi sırasında karşılaşılan zorluklar, sağlık profesyonelleri, araştırmacılar ve hastalar için önemli öğrenme fırsatları sunar.
Ar-Ge Yoğunluğunda Değişimler
2008-2019 yılları arasında, ilaç endüstrisi satışlarda %15,6'lık bir düşüş yaşarken, Ar-Ge yoğunluğunu %11,9'dan %17,7'ye çıkarmıştır.
Büyük ilaç şirketlerinin Ar-Ge yoğunluğu %16,6'dan %19,3'e yükselmiş ve satışlar %10 oranında artmıştır (380 milyar dolardan 418,0 milyar dolara).
Buna karşın, ilaç geliştirme maliyeti nispeten sabit kalmış veya azalmış olabilir.
Araştırmacıların Yorumu
Araştırmacılar, çalışmalarının sonuçlarını şöyle özetlemiştir: "Bu sonuçlar, ilaç geliştirme maliyetlerinin büyüklüğünü ve bu maliyetlerle ilişkili faktörleri anlamanın, ilaç politikalarının tasarımı ve bu politikaların yenilik ve rekabet üzerindeki olası etkilerini değerlendirmek için önemli olduğunu göstermektedir."
*
Dr. Aylin Sertkaya Kimdir?
Dr. Aylin Sertkaya, Eastern Research Group, Inc. (ERG), Lexington, Massachusetts'te kıdemli ekonomist ve başkan yardımcısı olarak görev yapmaktadır. Kariyeri boyunca federal ve eyalet kurumlarına yönelik birçok kamu politikası girişimini desteklemek amacıyla ekonomik ve politika analizleri tasarlamış ve yürütmüştür. Dr. Sertkaya, ekonomistler, istatistikçiler, bilim insanları ve ulusal düzeyde tanınmış uzmanlardan oluşan ekipler kurarak ve liderlik ederek, yüksek profilli birçok politika girişimini desteklemiştir. Çalışmaları JAMA Network Open, American Journal of Infection Control, Human and Ecological Risk Assessment, Applied Health Economics and Health Policy, ve Clinical Trials gibi hakemli dergilerde yayımlanmıştır.
FDA'nın 21. Yüzyıl cGMP (mevcut İyi Üretim Uygulamaları) girişimi kapsamında etkili kalite sistemleri ve risk yönetimi yaklaşımları üzerindeki çalışmaları nedeniyle FDA'dan Takdir Ödülü almıştır. Ekonomik ve Fayda Analizi Uzmanlık Grubu başkanlığı ve birçok oturumda başkanlık yapma gibi görevlerde bulunmuştur. Ulusal Bilimler, Mühendislik ve Tıp Akademileri Komitesi'nde, Amerika Birleşik Devletleri'nde antimikrobiyal direncin uzun vadeli sağlık ve ekonomik etkilerini inceleyen çalışmalarda yer almış ve 2021 yılında yayımlanan "Combating Antimicrobial Resistance and Protecting the Miracle of Modern Medicine" adlı kitaba katkıda bulunmuştur. Dr. Sertkaya, ekonomi alanında doktora ve fizik ile ekonomi alanlarında lisans derecelerine sahiptir, ayrıca matematik alanında yan dal yapmıştır.
Sertkaya A, Beleche T, Jessup A, Sommers BD. Costs of Drug Development and Research and Development Intensity in the US, 2000-2018. JAMA Netw Open. 2024;7(6):e2415445. doi:10.1001/jamanetworkopen.2024.15445