
2023 Nobel Tıp Ödülü – mRNA Aşılarının Gelişimini Mümkün Kılan Keşifler
2023 Nobel Fizyoloji veya Tıp Ödülü, Katalin Karikó ve Drew Weissman’a, COVID-19'a karşı etkili mRNA aşılarının geliştirilmesini sağlayan nükleozid baz modifikasyonları hakkındaki keşifleri için verildi.
Bu iki Nobel ödüllü bilim insanının keşifleri, 2020 başında başlayan pandemi sırasında COVID-19’a karşı etkili mRNA aşılarını geliştirmek adına kritik öneme sahipti. Bu çığır açan bulgular, mRNA'nın bağışıklık sistemimizle nasıl etkileşimde bulunduğunu anlamamızı temelden değiştirerek, modern zamanların en büyük insan sağlığı tehditlerinden biri sırasında aşı geliştirme hızındaki eşi benzeri görülmemiş artışa katkıda bulundu.
4 Maddede 2023 Nobel Tıp Ödülü'nün Özeti
1. mRNA'nın Temeli:
mRNA, hücrelerimizdeki genetik bilgiyi protein üretimi için bir şablona dönüştürür. 1980'lerde in vitro transkript yöntemi ile hücre kültürü olmadan mRNA üretimi mümkün hale geldi.
2. İlk Zorluklar:
İn vitro transkripte mRNA, kararsız ve teslim edilmesi zordu, ayrıca inflamatuar reaksiyonlara neden oluyordu. Bu, klinik uygulamalar için mRNA teknolojisinin geliştirilmesine olan ilk coşkuyu sınırladı.
3. Baz Modifikasyonları:
Karikó ve Weissman, in vitro transkripte mRNA'nın inflamatuar yanıtlara neden olmasının, mRNA bazlarında kimyasal modifikasyonların eksikliğinden kaynaklandığını keşfetti. Karikó ve Weissman, laboratuvar ortamında üretilen mRNA'nın, memeli hücrelerinden gelen doğal mRNA'dan farklı olarak inflamatuar yanıtlara neden olduğunu gözlemlediler. Bu inflamatuar yanıtlar, mRNA'nın hücreler tarafından yabancı bir madde olarak tanınmasından kaynaklanıyordu. Araştırmacılar, memeli hücrelerinden gelen doğal mRNA'nın bazlarında kimyasal modifikasyonlar olduğunu ve bu modifikasyonların, laboratuvar ortamında üretilen mRNA'da olmadığını fark ettiler.
4. İnflamatuar Yanıtın Azaltılması:
Karikó ve Weissman, bu sorunu aşmak ve in vitro transkripte mRNA'nın inflamatuar yanıtlara neden olmasını engellemek amacıyla, mRNA bazlarında kimyasal modifikasyonlar yapmayı denediler. Yaptıkları modifikasyonlar, mRNA'nın hücreler tarafından yabancı bir madde olarak tanınmasını engelledi ve inflamatuar yanıtları büyük ölçüde azalttı. Bu keşif, mRNA'nın terapötik ve aşı uygulamalarında kullanılmasının önündeki büyük bir engeli kaldırdı ve mRNA tabanlı aşıların geliştirilmesinin yolunu açtı.
Pandemi Öncesi Aşılar
Aşılar, belirli bir patojene karşı bağışık yanıtın oluşumunu teşvik eder. Bu, daha sonraki bir maruz kalma durumunda hastalıkla mücadelede vücuda bir başlangıç avantajı sağlar. Uzun zamandır öldürülmüş veya zayıflatılmış virüslere dayalı aşılar mevcuttur; polio, kızamık ve sarı humma aşıları bunlara örnektir.
Moleküler biyolojideki ilerlemeler sayesinde, bütün virüsler yerine bireysel viral bileşenlere dayalı aşılar geliştirildi. Bunun en güzel örnekleri HPV ve hepatit-B aşılarıdır. Viral genetik kodun parçaları, genellikle virüs yüzeyinde bulunan proteinleri kodlayarak, virüsü engelleyen antikorların oluşumunu teşvik edecek proteinler üretmek için kullanıldı.
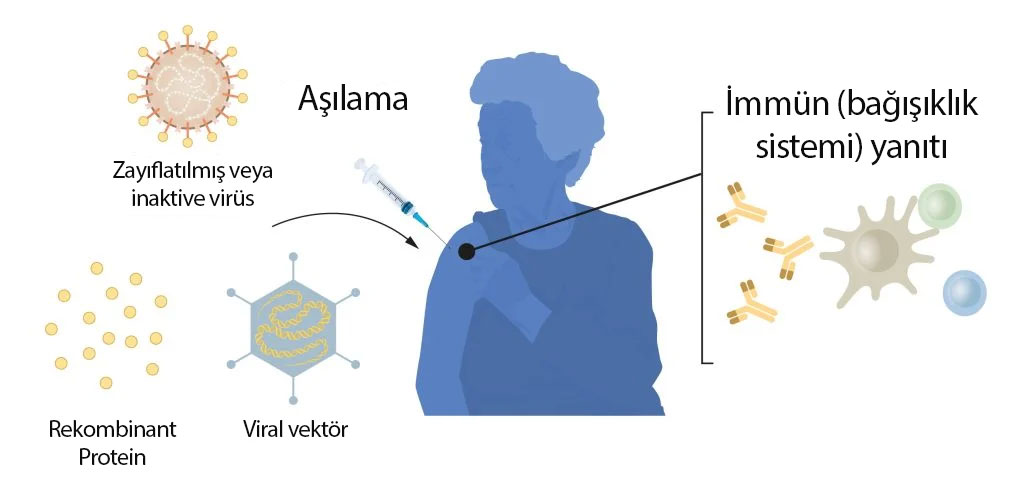
Şekil 1. COVID-19 salgını öncesi aşı üretim yöntemleri.
mRNA Aşıları: Umut Verici Bir Fikir
Hücrelerimizde, DNA'da kodlanan genetik bilgi, protein üretimi için bir şablon olarak kullanılan haberci RNA'ya (mRNA) transfer edilir.
1980'lerde, hücre kültürüne gerek duymadan mRNA üretmek için etkili yöntemlerin tanıtılması, in vitro transkript olarak bilinen bu teknoloji, moleküler biyoloji uygulamalarının geliştirilmesinde belirleyici bir adım oldu. Birkaç alanda bilimsel çalışmaların ilerlemesini hızlandırarak, mRNA teknolojilerinin aşı ve terapötik amaçlar için potansiyelini gösterdi. Ancak, bu yeni yönelimin önünde ciddi engeller vardı.
İn vitro transkripte mRNA, kararsız ve teslimatı zor olarak görülmekteydi. mRNA'nın hücrelere etkili bir şekilde ulaştırılabilmesi için, mRNA moleküllerini kapsülleyecek sofistike taşıyıcı lipid sistemlerinin geliştirilmesi gerekiyordu. Bu taşıyıcı sistemler, mRNA'nın hücrelere güvenli ve etkili bir şekilde ulaştırılmasını sağlamak amacıyla tasarlanmıştı.
Ayrıca, laboratuvar ortamında üretilen mRNA'nın inflamatuar reaksiyonlara, yani iltihaplanma yanıtlarına neden olduğu gözlemlendi. Bu inflamatuar yanıtlar, mRNA tabanlı terapötik uygulamaların veya aşıların geliştirilmesini zorlaştıran bir başka engel olarak ortaya çıktı.
Bu engeller, başlangıçta mRNA teknolojisinin klinik amaçlar için geliştirilmesine olan coşkuyu sınırladı. mRNA'nın kararsız doğası ve inflamatuar yanıtları, bu teknolojiye olan ilk ilgiyi ve potansiyel uygulamalarını olumsuz etkiledi.
Ancak, bu zorluklar aşıldıkça ve bilim insanları mRNA'nın nasıl optimize edileceği ve hücrelere nasıl etkili bir şekilde ulaştırılacağı konusunda daha fazla bilgi edindikçe, mRNA tabanlı terapötikler ve aşılar konusundaki araştırmalar zamanla hız kazandı. Bu, özellikle COVID-19 pandemisi sırasında mRNA tabanlı aşıların hızlı gelişiminde belirgin hale geldi.
Bu engeller, mRNA'yı terapi için kullanma yöntemlerini geliştirmeye kendini adamış olan Macar biyokimyacı Katalin Karikó'yu yıldırmadı. 1990'ların başlarında, University of Pennsylvania'da yardımcı doçent olduğunda, projenin önemi konusunda araştırma fon sağlayıcılarını ikna etmede zorluklar yaşamasına rağmen, mRNA'nın terapötik olarak gerçekleştirilmesi vizyonuna sadık kaldı.
Karikó'nun üniversitesindeki yeni bir meslektaşı, immunolog Drew Weissman’dı. O, bağışıklık gözetimi ve aşıya özgü bağışık yanıtlarının aktivasyonunda önemli işlevleri olan dendritik hücrelerle ilgileniyordu. İkisi arasında, farklı RNA türlerinin bağışıklık sistemiyle nasıl etkileşime girdiğine odaklanan verimli bir işbirliği başladı.
Çığır Açan Buluş
Dendritik Hücrelerin Rolü:
- Karikó ve Weissman, dendritik hücrelerin laboratuvar ortamında (in vitro) üretilen mRNA'yı yabancı bir madde olarak tanıdığını ve bu tanımanın, inflamatuar (iltihap yaratıcı) sinyal moleküllerinin salınmasını ve dendritik hücrelerin aktivasyonunu tetiklediğini gözlemlediler.
- Dendritik hücreler, bağışıklık sisteminin bir parçasıdır ve vücuda giren yabancı maddeleri (örneğin, mikropları) tanımlama görevini üstlenirler.
İn Vitro ve Memeli Hücrelerinden Gelen mRNA Arasındaki Fark:
- Araştırmacılar, laboratuvar ortamında üretilen mRNA'nın yabancı olarak tanınırken, memeli hücrelerinden gelen doğal mRNA'nın aynı tepkiyi göstermediğini fark ettiler. Bu durum, onları, farklı mRNA türleri arasındaki temel farkları sorgulamaya yönlendirdi.
RNA'nın Kimyasal Bileşimi:
- RNA'nın temel yapı taşları olan dört baz (A, U, G, C) vardır ve bu bazlar DNA'daki bazlarla eşleşir.
- Karikó ve Weissman, memeli hücrelerinden elde edilen RNA'nın bazlarında kimyasal modifikasyonlar olduğunu, ancak laboratuvar ortamında üretilen mRNA'nın bu modifikasyonlara sahip olmadığını keşfetti.
Baz Modifikasyonlarının İnflamatuar Yanıt Üzerine Etkisi:
- Araştırmacılar, kimyasal baz modifikasyonlarının olup olmadığını kontrol etmek amacıyla farklı mRNA varyantları ürettiler ve bu varyantları dendritik hücrelere teslim ettiler.
- Baz modifikasyonları içeren mRNA varyantları, inflamatuar yanıtı neredeyse tamamen ortadan kaldırdı. Bu, mRNA'nın hücreler tarafından nasıl tanındığı ve nasıl yanıt verdiği üzerine yeni bir bakış açısı getirdi.
Sonuç ve Uygulamalar:
- Karikó ve Weissman, bu keşiflerinin mRNA'nın terapötik (tedavi edici) amaçlar için kullanılmasında büyük bir potansiyel taşıdığını fark etti.
- Bu bulgular 2005 yılında yayınlandı ve mRNA teknolojisinin tıbbi uygulamalarını ilerletme yönünde önemli bir adım oldu. Bu çalışma, özellikle COVID-19 pandemisi sırasında mRNA tabanlı aşıların hızlı bir şekilde geliştirilmesine olanak tanıdı ve bu nedenle çok önemli bir bilimsel katkı olarak kabul edildi.
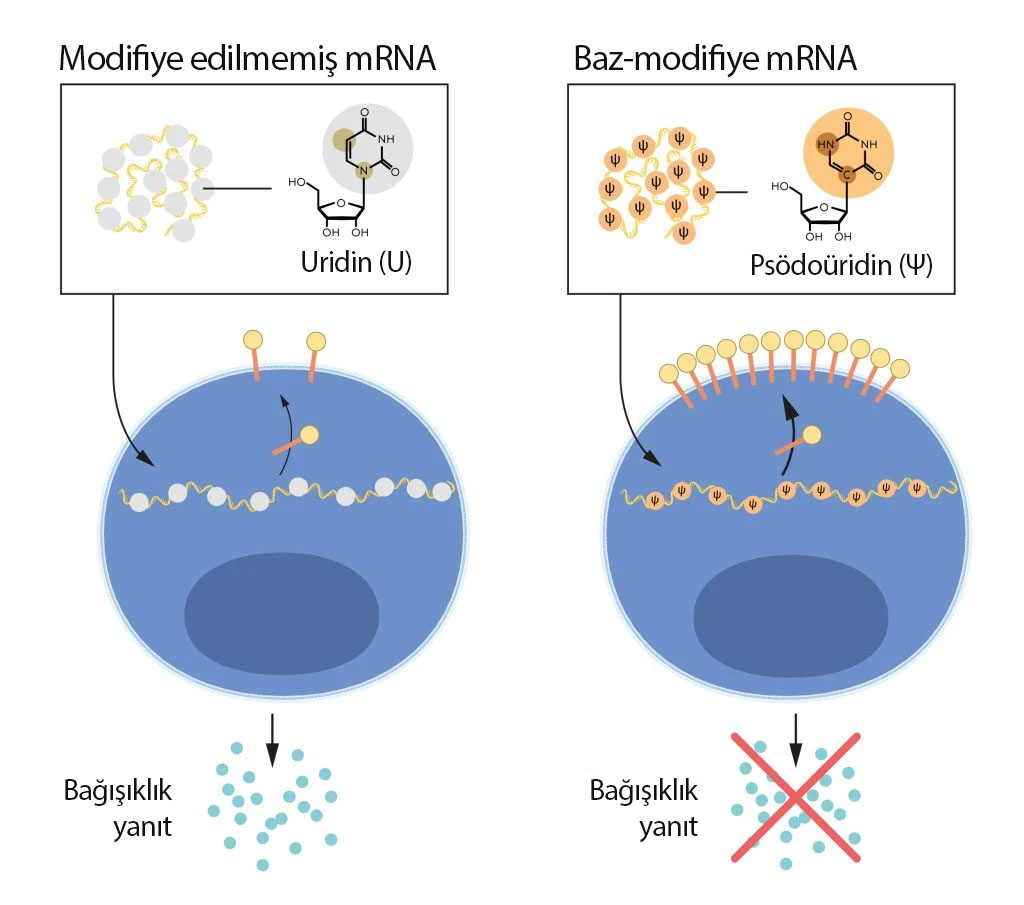
Şekil 2'de mRNA'nın içerdiği dört farklı bazın bir gösterimi bulunmaktadır. mRNA, A, U, G ve C olarak kısaltılmış dört farklı baza sahiptir. Nobel ödüllü bilim insanları, baz-modifiye mRNA'nın, inflamatuar reaksiyonları (sinyal moleküllerinin salınmasını) engellemek ve mRNA hücrelere teslim edildiğinde protein üretimini artırmak için kullanılabileceğini keşfetti.
2008 ve 2010'da yayınlanan daha ileri çalışmalarda, Karikó ve Weissman, baz modifikasyonları ile üretilen mRNA'nın teslimatının, modifiye edilmemiş mRNA'ya göre protein üretimini belirgin bir şekilde artırdığını gösterdi. Etki, protein üretimini düzenleyen bir enzimin azaltılmış aktivasyonundan kaynaklanıyordu. Baz modifikasyonlarının hem inflamatuar yanıtları azalttığını hem de protein üretimini artırdığını keşfeden Karikó ve Weissman, mRNA'nın klinik uygulamalarına giden yoldaki kritik engelleri ortadan kaldırmış oldular.
mRNA Aşıları Potansiyellerini Gerçekleştirdi
mRNA teknolojisine olan ilgi artmaya başladı ve 2010'da birkaç şirket bu yöntemi geliştirmek üzere çalışıyordu. Zika virüsü ve MERS-CoV'a karşı aşılar takip edildi; sonuncusu SARS-CoV-2'ye yakından ilişkilidir. COVID-19 pandemisinin patlak vermesinin ardından, SARS-CoV-2 yüzey proteinini kodlayan iki baz-modifiye mRNA aşısı rekor hızda geliştirildi. %95 civarında koruyucu etkiler bildirildi ve her iki aşı da 2020'nin Aralık ayında onaylandı.
mRNA aşılarının geliştirilmesindeki etkileyici esneklik ve hız, bu yeni platformun diğer bulaşıcı hastalıklara karşı aşılar için de kullanılmasına olanak tanır. Gelecekte, bu teknoloji, terapötik proteinlerin teslimatı ve bazı kanser türlerinin tedavisi için de kullanılabilir.
SARS-CoV-2'ye karşı, farklı metodolojilere dayalı birkaç diğer aşı da hızla tanıtıldı ve birlikte, dünya genelinde 13 milyardan fazla COVID-19 aşı dozu uygulandı. Aşılar milyonlarca hayatı kurtardı ve birçoklarında ciddi hastalıkları önledi, toplumların açılmasına ve normal koşullara dönmesine olanak tanıdı. mRNA'daki baz modifikasyonlarının önemini keşfeden temel bulguları sayesinde, bu yılın Nobel ödüllü bilim insanları, zamanımızın en büyük sağlık krizlerinden biri sırasında bu dönüştürücü gelişmeye kritik bir şekilde katkıda bulundular.
Nobel Ödülü için En Kritik Bilimsel Yayınlar
1. Karikó, K., Buckstein, M., Ni, H. and Weissman, D. Suppression of RNA Recognition by Toll-like Receptors: The impact of nucleoside modification and the evolutionary origin of RNA. Immunity 23, 165–175 (2005).
2. Karikó, K., Muramatsu, H., Welsh, F.A., Ludwig, J., Kato, H., Akira, S. and Weissman, D. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther 16, 1833–1840 (2008).
3. Anderson, B.R., Muramatsu, H., Nallagatla, S.R., Bevilacqua, P.C., Sansing, L.H., Weissman, D. and Karikó, K. Incorporation of pseudouridine into mRNA enhances translation by diminishing PKR activation. Nucleic Acids Res. 38, 5884–5892 (2010).
Katalin Karikó 1955 yılında Macaristan'ın Szolnok şehrinde doğdu. Doktora derecesini 1982 yılında Szeged Üniversitesi'nden aldı ve 1985 yılına kadar Szeged'deki Macar Bilimler Akademisi'nde doktora sonrası araştırmalar yaptı. Daha sonra Philadelphia'daki Temple Üniversitesi ve Bethesda Sağlık Bilimleri Üniversitesi'nde doktora sonrası araştırmalar yaptı. 1989 yılında Pensilvanya Üniversitesi'ne Yardımcı Doçent olarak atandı ve 2013 yılına kadar bu görevde kaldı. Daha sonra BioNTech RNA Pharmaceuticals'da başkan yardımcısı ve daha sonra kıdemli başkan yardımcısı oldu. 2021 yılından bu yana Szeged Üniversitesi'nde Profesör ve Pensilvanya Üniversitesi Perelman Tıp Fakültesi'nde Yardımcı Profesör olarak görev yapmaktadır.
Drew Weissman 1959'da Lexington, Massachusetts, ABD'de doğdu. MD, PhD derecelerini 1987 yılında Boston Üniversitesi'nden aldı. Klinik eğitimini Harvard Tıp Fakültesi Beth Israel Deaconess Tıp Merkezi'nde, doktora sonrası araştırmalarını ise Ulusal Sağlık Enstitüleri'nde yaptı. 1997 yılında Weissman, Pennsylvania Üniversitesi Perelman Tıp Fakültesi'nde araştırma grubunu kurdu. Aşı Araştırmalarında Roberts Ailesi Profesörü ve Penn RNA Yenilikleri Enstitüsü Direktörüdür.
Press release. NobelPrize.org. Nobel Prize Outreach AB 2023. Mon. 2 Oct 2023.






