4. Evre Baş ve Boyun Kanserleri Tedavisi için Nivolumab Adlı İmmünoterapi İlacı FDA Onayı Aldı
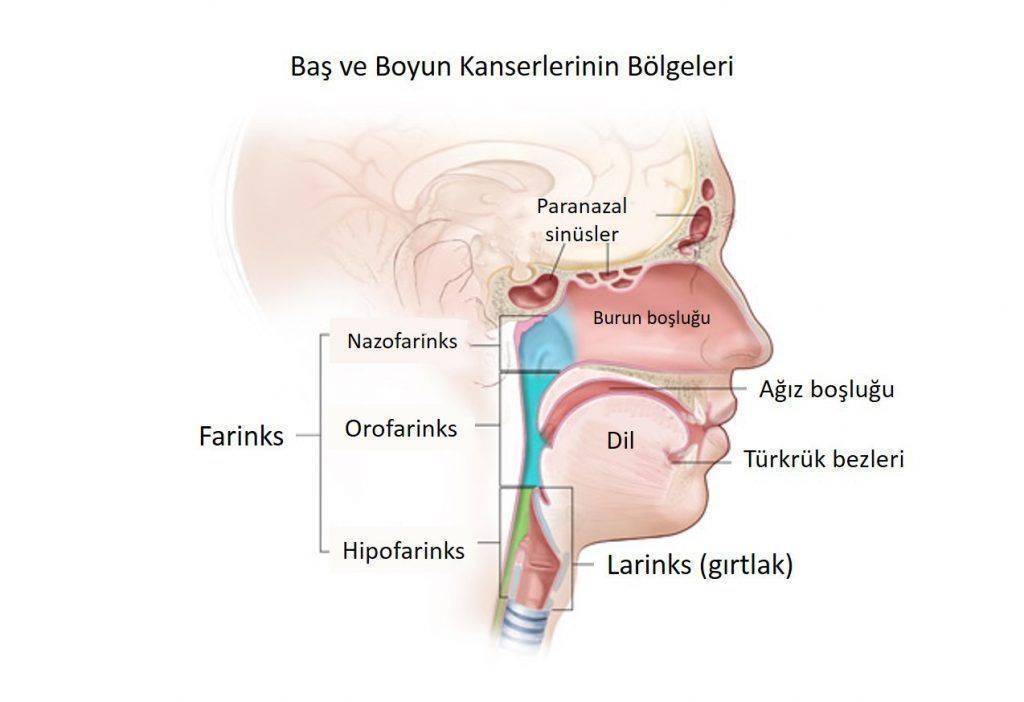
Amerika İlaç Dairesi (FDA) 10 Kasım'da, 4. evre veya yineleyen yassı hücreli baş ve boyun kanserlerinin tedavisi için bir immünoterapi ilacı olan Nivolumab (Opdivo) adlı ilacın kullanımına onay verdi. Baş ve boyun kanserlerinin (BBK) en sık görülen hücresel tipi yassı (skuamöz) hücreli karsinomdur ve bu kanserlerin en sık yerleşim yeri de hava ile temas halindeki anatomik bölgelerdir (ağız içi, yutak, gırtlak gibi). İşte Nivolumab, tekrarlamış veya yayılım yapmış (metastatik = 4. evre), platin bazlı kemoterapi altında veya sonrasında hastalığı kötüye giden yassı hücreli BBK için onaylanmıştır.
Çalışma
CheckMate 141 adlı faz-3 klinik çalışma Nivolumab'a BBK tedavisinde kullanım onayı getirmiştir. Çalışmaya, bu kanser grubunun standart kemoterapisi olan platin bazlı ilaçlar sonrası hastalığı yineleyen veya 4. evre hastalığa sahip 361 skuamöz hücreli baş boyun kanserli hasta katılmıştır. Bu hastaların bir kısmına tümör ilerleme/yayılım gösterene kadar yeni nesil kanser immünoterapi ilacı Nivolumab (3 mg/kg dozunda her 2 haftada bir) verilirken bir kısmına klinisyenin tercihi doğrultusunda standart kemoterapi ilaçlarından biri (Setuksimab, Metotreksat, veya Dosetaksel) uygulanmıştır.
Standart kemoterapi alan hastalara nazaran Nivolumab alan hastalarda daha olumlu sonuçlar elde edildiği görülmüştür. Çalışmanın en önemli sonucu olarak genel ortanca sağkalım Nivolumab uygulananlarda 7,5 ay iken, kemoterapi alanlarda 5,1 ay olarak bulunmuştur.
Nivolumab for SCCHN. https://www.fda.gov/






