4. evre veya tekrarlayan Over kanseri tedavisinde olaparib FDA onayı aldı
17 Ağustos 2017'de, ABD Gıda ve İlaç Dairesi FDA, daha önce platin bazlı kemoterapiye tam veya kısmi yanıt vermiş, tekrarlayan kadın yumurtalık (over), fallop tüpü veya peritoneal (karın zarı) kanserli yetişkin hastaların idame tedavisinde olaparib tabletlerine (Lynparza) onay verdi.
Fallop tüpü; sağ ve sol yumurtalıkla komşu olarak başlayan ve dölyatağının (rahim) her iki yanında, üst yan köşelerde sonlanan borucuklardır.
FDA daha önce 2014 yılında, üç basamak veya daha fazla kemoterapi uygulanan, kalıtsal BRCA gen mutasyonu olan over kanserli hastaların tedavisinde olaparibin kapsül formlarını onaylamıştı. Olaparibin tablet formları, kapsül formlarına göre kullanım kolaylığı sunuyor; kapsül formunu günde 2 kez 8'er kapsül almak gerekiyordu, fakat tablet formu günde 2 kez 2 adet kullanılıyor.
İdame tedavinin onayı, over kanserinin standart tedavisi olan platin esaslı tedaviye yanıt veren, tekrarlayan over kanserli hastalarda iki randomize, plasebo kontrollü, çift-kör, çok merkezli çalışmaya dayanmaktadır.
SOLO-2 adlı klinik çalışmada, BRCA gen mutasyonu olan tekrarlayan over, fallop tüpü veya primer periton kanserli 295 hastaya günde iki kez 300 mg olaparib tabletleri veya plasebo (etken madde içermeyen ilaç) verilmiş. Olaparib verilen hastalarda, kanserin tedavi ile kontrol altında tutulma süresi ortanca 19.1 ay bulunurken, plasebo kolunda ise 5.5 ay olarak bulunmuştur.
Diğer çalışmada ise, BRCA mutasyon durumundan bağımsız olarak 265 hasta, günde iki kez 400 mg olaparib kapsülleri veya plasebo verilmek üzere iki kola ayrılmıştır. Olaparib kolunda istatiksel olarak anlamlı iyileşme gösterilmiş ve kanserin tedavi ile kontrol altında tutulma süresi ortanca 8.4 ay bulunurken, plasebo kolunda ise 4.8 ay olarak rapor edilmiştir.
Klinik çalışmalarda en sık (≥%20) görülen yan etkiler kansızlık, mide bulantısı, yorgunluk, kusma, boğaz enfeksiyonu, ishal, eklem ve kas ağrısı, kulak çınlaması, baş ağrısı, hazımsızlık, iştah azalması, kabızlık ve ağız yaralarıdır. En sık görülen laboratuvar değerleri anormallikleri (≥%25) ise hemoglobin düşüşü, lenfositlerde azalma, lökositlerde azalma, mutlak nötrofil sayısında azalma, serum kreatinininde artış ve trombositlerde azalmadır.
Önerilen olaparib tablet dozu hem idame tedavisinde hem de ileri basamak tedavilerde (aç veya tok) günde iki kez ağızdan alınan 300 mg'dır (iki adet 150 mg tablet).
Olaparib etki mekanizması nasıldır?
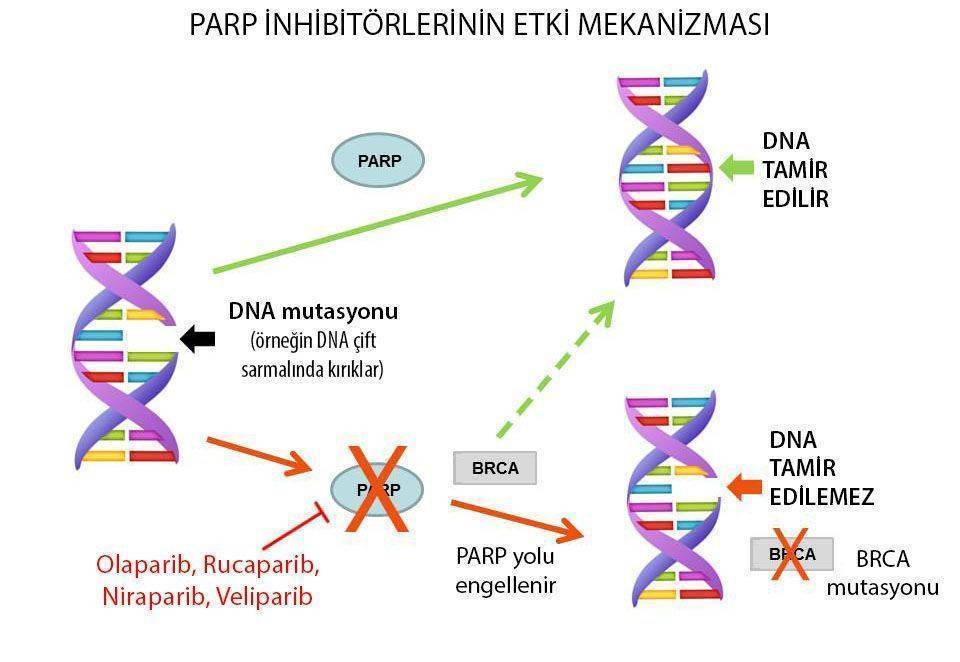
Olaparibin etki ettiği BRCA ve PARP genleri DNA hasarlarının tamirinde görev alırlar. Bu genlerden sadece birisi bozuksa, kanser hücresi yaşamına devam eder. Ancak ikisi de bozulursa kanser hücresi DNA tamirini etkili bir şekilde gerçekleştiremez. Araştırmacılar BRCA geni bozuk olan hastalarda, PARP genini hedef alarak kanser hücrelerini yok etmeyi başarmışlardır. Sonuçta olaparib, DNA tamirinde görevli bir enzim olan PARB’ı engelleyerek DNA tamir defektlerine hassas tümör hücrelerini hedef alan bir ilaçtır.
fda.gov






