FDA, İleri Evre HR-Pozitif, HER2-Negatif Meme Kanserinde Datopotamab Derukstekanı Onayladı
17 Ocak 2025'te, ABD Gıda ve İlaç Dairesi (FDA), metastatik veya cerrahi müdahaleye uygun olmayan, hormon reseptörü (HR) pozitif, insan epidermal büyüme faktörü reseptörü 2 (HER2) negatif (IHK 0, IHK1+ veya IHK2+/ISH-) meme kanseri olan ve daha önce bu tür metastatik hastalık için endokrin bazlı tedavi ve kemoterapi almış yetişkin hastalar için, Trop-2'ye yönelik antikor ve topoisomerase inhibitör konjugatı olan datopotamab deruxtecan-dlnk (Datroway, Daiichi Sankyo, Inc.) onayını verdi.
Bu, datopotamab deruxtecan (Dato-DXd) adlı antikor ilaç konjugatı (AİK) için verilen ilk FDA onayıdır.
Trop-2 Nedir? Trop-2 Hedefli Kanser İlaçları Hangileridir?
Trop-2 (Trofoblast Hücre Yüzeyi Antijeni-2), birçok epitelyal kanser türünde aşırı eksprese edilen bir transmembran glikoproteindir ve tümör hücrelerinin büyümesi, çoğalması ve metastazında rol oynar. Bu nedenle, Trop-2'yi hedef alan tedaviler, kanser tedavisinde önemli bir araştırma konusu haline gelmiştir.
Sacituzumab govitecan (Trodelvy), Trop-2'yi hedefleyen ve SN-38 adlı topoizomeraz I inhibitörünü içeren bir antikor-ilaç konjugatıdır. Bu ilaç, Trop-2'ye bağlandıktan sonra hücre içine alınarak SN-38'i serbest bırakır ve DNA replikasyonunu engelleyerek kanser hücrelerinin ölümüne neden olur. Meme kanseri ve ürotelyal kanser için onaylıdır (bakınız onayların detayları).
Datopotamab deruxtecan, FDA onayı alan ikinci Trop-2 hedefli antikanser ilaçtır.
TROPION-Breast01 Çalışması ile Gelen FDA Onayı
Bu onay, 732 hastanın katıldığı, randomize, çok merkezli, açık etiketli TROPION-Breast01 denemesinden elde edilen bulgulara dayanmaktadır. Bu denemede, daha fazla endokrin tedaviye uygun olmayan ve daha önce iki kere kemoterapi almış hastalar yer almıştır.
Sonuçlar, datopotamab deruxtecan (Dato-DXd) alan 365 hastayla, eribulin, kapesitabin, vinorelbin veya gemsitabin seçimine bağlı kemoterapi alan 367 hastayla kıyaslandığında, yanıt oranlarında ve progresyonsuz sağkalımda (PFS) iyileşme göstermiştir.
Sonuçlar
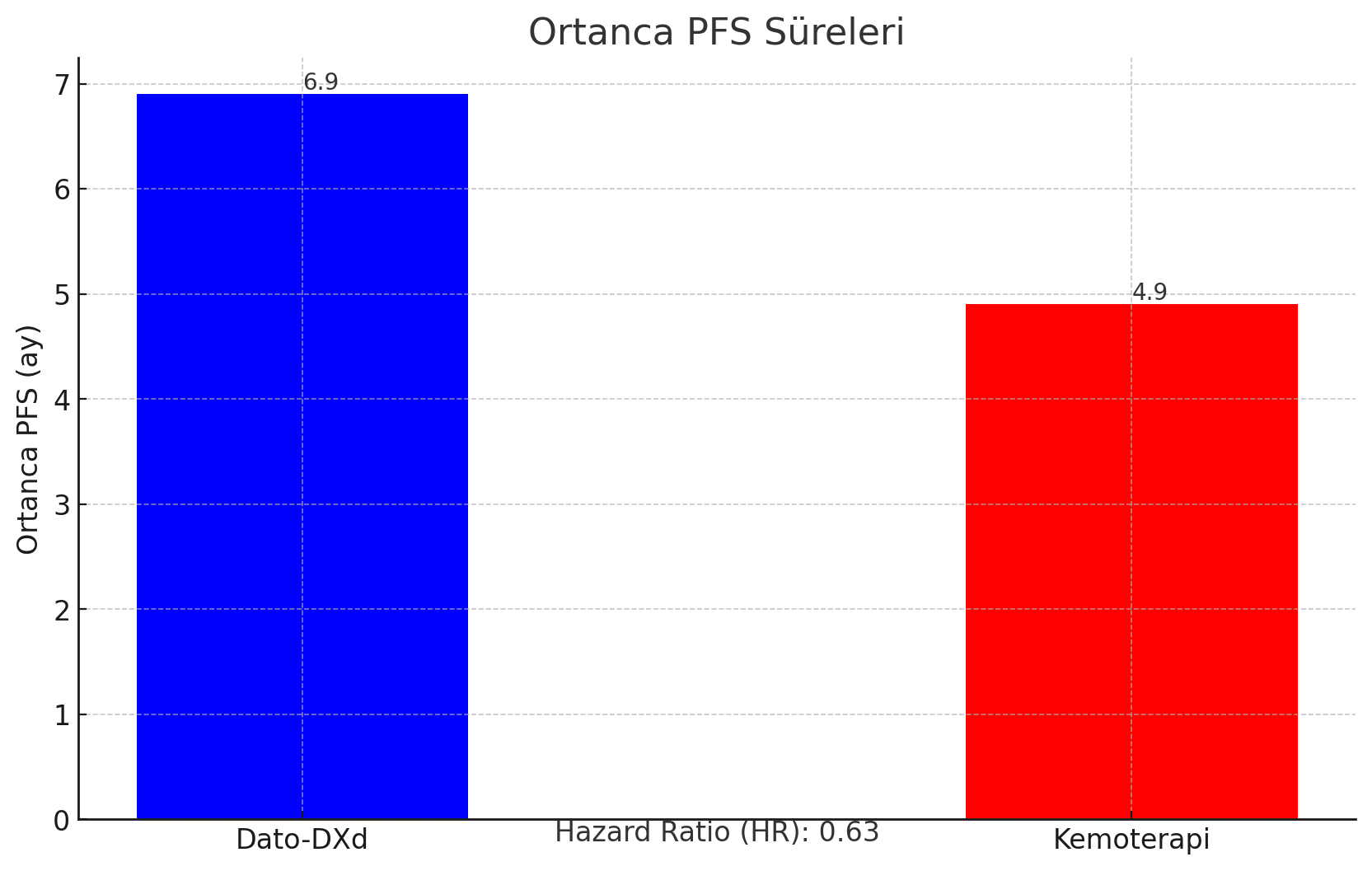
- Ortanca PFS, Dato-DXd ve kemoterapi kollarında sırasıyla 6.9 ve 4.9 ay olarak belirgin bir şekilde daha uzundur (hazard oranı [HR], 0.63).
- Ortanca genel sağkalım, sırasıyla 18.6 ve 18.3 ay olarak (HR, 1.01) iki kol arasında belirgin bir fark göstermemiştir.
- Onaylanan genel yanıt oranı %36 ve %23, medyan yanıt süresi ise sırasıyla Dato-DXd ve kemoterapi kollarında 6.7 ve 5.7 aydır.
Yan Etkiler
En az %20 hastada görülen advers reaksiyonlar arasında, laboratuvar anormallikleri de dahil olmak üzere, ağız yarası, bulantı, yorgunluk, azalmış lökositler, azalmış kalsiyum, alopesi, azalmış lenfositler, azalmış hemoglobin, kabızlık, azalmış nötrofiller, kuru göz, kusma, artmış alanin aminotransferaz, keratit, artmış aspartat aminotransferaz ve artmış alkalen fosfataz bulunmaktadır.
Deneme bulguları, Dato-DXd alan hastaların, kemoterapi alan hastalara kıyasla, daha az sayıda derece 3 veya daha yüksek toksisiteler ve daha az doz azaltmaları veya kesintileri yaşadığını göstermiştir.
Dozu
Önerilen Dato-DXd dozu, hastalık ilerlemesi veya kabul edilemez toksisiteye kadar, üç haftada bir kez intravenöz infüzyonla 6 mg/kg — 90 kg ve üzeri ağırlığı olan hastalar için maksimum 540 mg — olarak belirlenmiştir.
ABD'deki bu onay, Aralık 2024'te Japonya'daki onayı takip etmekte, ve FDA ayrıca belirli küçük hücreli olmayan akciğer kanserleri için Dato-DXd kullanımına yönelik bir Biyolojik Lisans Başvurusuna öncelikli inceleme hakkı tanımıştır, Daiichi Sankyo'nun belirttiği üzere; “kapsamlı küresel klinik geliştirme programı, küçük hücreli dışı akciğer kanseri, üçlü negatif meme kanseri ve HR pozitif, HER2 düşük veya negatif meme kanseri dahil çoklu kanser türlerinde datopotamab deruxtecanın etkinliği ve güvenliği değerlendiren 20'den fazla deneme ile devam etmektedir.”






