
Trodelvy (sacituzumab govitecan-hziy) FDA Onay Geçmişi
- FDA onaylı: Evet (İlk onay tarihi 22 Nisan 2020)
- Kutu adı: Trodelvy
- Etken madde adı: Sacituzumab govitecan-hziy
- Uygulama şekli: İntravenöz enjeksiyon
- Sınıfı: Antikor-ilaç kojugatı
- Kategori: Biyolojik yanıt modifiye edici ajan, kemoterapi ilacı
- Üretici: Immunomedics, Inc.
- Türkiye dağıtımı: Gilead Sciences İlaç LTD. ŞTİ.
- Onaylı olduğu kanserler: Meme kanseri, ürotelyal (idrar yolları ve mesane) kanser
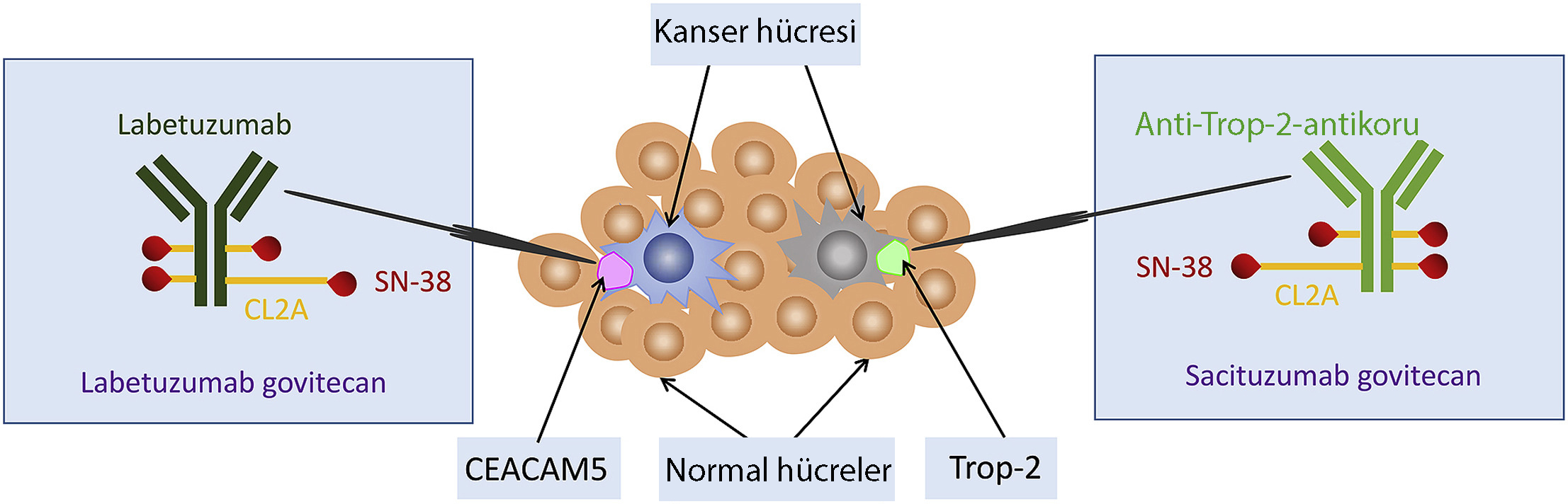
Sacituzumab govitecan-hziy Etki Mekanizması Nasıldır?
- Bir topo I inhibitörü olan SN-38'e konjüge edilmiş Trop-2'ye yönelik hümanize monoklonal antikor sacituzumab, bir antikor-ilaç konjugatıdır. Her bir antikor molekülüne yaklaşık 7-8 SN-38 molekülü konjuge edilir.
- Trop-2'ye bağlandıktan sonra sacituzumab govitecan hızla lizozomlara içselleştirilir ve daha sonra topo I proteinini hedeflemek ve inhibe etmek için hücrede SN-38 salınır. Topo I'in inhibisyonu, çift sarmallı DNA kırılmalarına ve nihai hücre ölümüne yol açar.
- Trop-2, hücre büyümesini ve proliferasyonunu, invazyonu, hücre hayatta kalmasını ve karsinogenezi uyarmak için ERK/MAPK ve siklin D1 sinyal yolları aracılığıyla çalışan 46-kDa'lık bir transmembran kalsiyum sinyal proteinidir.
- Trop-2, meme kanseri de dahil olmak üzere birçok epitelyal solid tümörde aşırı eksprese edilir ve ekspresyonu, üçlü negatif meme kanserinin %85'inden fazlasında tespit edilir.
Trodelvy için FDA Onayı Zaman Çizelgesi
- 3 Şubat 2023: Sacituzumab Govitecan, Hormon Pozitif HER2 Negatif İleri Evre Meme Kanseri için FDA Onayı Aldı
- 13 Nisan 2021: İleri Evre Ürotelyal (mesane-idrar yolu) Kanseri için Sacituzumab Govitecan FDA Onayı Aldı
- 22 Nisan 2020: Sacituzumab Govitecan-hziy, İleri Evre Üçlü Negatif Meme Kanseri Tedavisinde FDA Onayı Aldı
Trodelvy için Türkiye Ruhsatı
Trodelvy, ilk olarak 25.01.2023 tarihinde aşağıdaki endikasyonla T.C. Sağlık Bakanlığı Ruhsatı almıştır.
"Aktif beyin metastazı olmayan, önceden en az iki basamak kemoterapi almış (en az bir basamağı metastatik evrede alma şartıyla), rezeke edilemeyen lokal ilerlemiş veya metastatik üçlü negatif meme kanseri olan yetişkin hastaların tedavisinde endikedir."
Trodelvy Geri Ödemesi Var mı?
Trodelvy, aşağıda tarif edilen durum için Sosyal Güvenlik Kurumu (GSK) tarafından geri ödeme kapsamına alınmıştır.
"Aktif beyin metastazı olmayan, önceden en az iki basamak kemoterapi almış, rezeke edilemeyen lokal ileri veya metastatik triple negatif meme kanseri olan hastalarda progresyona kadar kullanılır."
Direnç Mekanizması
Henüz iyi bir şekilde tanımlanmadı.
Dağılım
İlacın plazma proteinlerine orta düzeyde bağlanması (%77). Kararlı durum ilaç seviyelerine 21 gün içinde ulaşılır.
Metabolizma
Sacituzumab govitecan ile resmi bir metabolizma çalışması yapılmamıştır, ancak antikor-ilaç konjugatının küçük peptidlere ve amino asitlere yıkılıyor olması beklenmektedir. SN-38, karaciğerde UGT1A1 tarafından metabolize edilir. Sacituzumab govitecanın ortanca terminal yarı ömrü 16 saattir ve serbest SN-38'in terminal yarı ömrü yaklaşık 18 saattir.
Doz
21 günlük tedavi döngülerinin 1. ve 8. günlerinde haftada bir kez intravenöz infüzyon şeklinde uygulanan 10 mg/kg'dır. İlk Trodelvy infüzyonu 3 saatte verilir ve sonraki dozlar, ilk doz iyi tolere edilirse 1 ila 2 saatte verilir. İnfüzyon reaksiyonlarını ve kemoterapinin neden olduğu bulantı ve kusmayı önlemeye yardımcı olmak için premedikasyon gereklidir.
İlaç Etkileşimi
UGT1A1 inhibitörleri - sacituzumab govitecanın UGT1A1 inhibitörleri ile eşzamanlı kullanımı, SN-38 ilaç düzeylerinin ve potansiyel olarak toksisitenin artmasına neden olabilir.
UGT1A1 indükleyicileri - sacituzumab govitecanın UGT1A1 indükleyicileri ile eşzamanlı kullanımı, SN-38 ilaç düzeylerinin düşmesine ve potansiyel olarak klinik aktivitenin azalmasına neden olabilir.
Dikkat Edilmesi Gerekenler
- Sacituzumab govitecan, IV yavaş infüzyon olarak uygulanmalı, IV puşe veya bolus olarak DEĞİL. İlk infüzyon 3 saat boyunca uygulanmalı ve hastalar infüzyon sırasında ve infüzyon tamamlandıktan sonra en az 30 dakika gözlenmelidir. Önceki infüzyon iyi tolere edilirse, sonraki tüm infüzyonlar için ilaç 1-2 saatte verilebilir.
- Hastalara infüzyondan önce antipiretikler, H1 ve H2 blokerleri ile premedikasyon yapılmalıdır ve daha önce infüzyon reaksiyonu yaşayan hastalarda steroidler kullanılabilir.
- Şiddetli nötropeni meydana gelebileceğinden tam kan sayımı ile hastayı yakından izleyin. Nötropenik atakları önlemek için G-CSF düşünülmelidir.
- Tedavi, SN-38'e kolinerjik bir yanıt olan ve infüzyon sırasında veya ilaç uygulamasından sonraki 24 saat içinde ishal, terleme ve karın kramplarından oluşan "erken diyare" sendromu ile komplike hale gelebilir. Önerilen tedavi, klinik olarak kontrendike olmadıkça IV uygulanan atropindir (0.25-1.0 mg). Profilaksi için rutin atropin kullanımı önerilmemektedir. Ancak kolinerjik olay geçirilmişse atropin profilaksisi uygulanmalıdır.
- Hastaları, derhal tedavi edilmediği takdirde ciddi dehidratasyona ve/veya elektrolit dengesizliklerine yol açabilecek geç diyare (ilaç uygulamasından 24 saat sonra başlayan) olasılığı hakkında bilgilendirin. Bu yan etkinin, SN-38 tarafından gastrointestinal mukozanın doğrudan tahrişine bağlı olduğu düşünülmektedir, ancak henüz tanımlanamayan diğer mekanizmalar söz konusu olabilir. Loperamid, ilk gevşek bağırsak hareketinden (ilk yumuşak gaita) hemen sonra alınmalıdır. Önerilen doz, yükleme dozu olarak 4 mg PO'dur, ardından 2 saatte bir 2 mg'dır (gece boyunca 4 saatte bir 4 mg). Loperamid, hasta 12 saat boyunca ishalden kurtulduktan sonra kesilebilir. İlk 24 saatte ishal düzelmeden devam ederse oral florokinolon antibiyotiği eklenmelidir. Devam eden diyare ile IV antibiyotik ve IV hidrasyon ile hastaneye yatış düşünülmelidir.
- Hafif karaciğer fonksiyon bozukluğu olan hastalarda doz azaltımı gerekli değildir. Sacituzumab govitecan, orta veya şiddetli karaciğer fonksiyon bozukluğu olan hastalarda çalışılmamıştır ve bu ortamlarda kullanımından kaçınılmalıdır.
- Böbrek yetmezliği veya son dönem böbrek hastalığı olan hastalarda çalışılmamıştır. UGT1A1 7/7 (UGT1A1*28) genotipine sahip hastalar, miyelosupresyon ve ishal gibi diğer yan etkiler açısından yüksek risk altında olabilir. Kuzey Amerika nüfusunun yaklaşık %10'u bu genotip için homozigottur.
- Hamile bir kadına verildiğinde fetal zarara neden olabilir. Üreme potansiyeli olan dişiler, tedavi sırasında ve son dozdan en az 2 ay sonra etkili kontrasepsiyon kullanmalıdır. Üreme potansiyeline sahip kadın partnerleri olan erkekler, tedavi sırasında ve son dozdan en az 4 ay sonra etkili doğum kontrol yöntemi kullanmalıdır. Emzirmekten kaçınılmalıdır.
Yan Etki 1
Nötropeni ile miyelosupresyon en sık gözlenir. Şiddetli veya yaşamı tehdit eden nötropeni oluşabilir.
Yan Etki 2
İshalin iki farklı şekli vardır: erken ve geç. Erken form, infüzyon sırasında veya ilaç tedavisinden sonraki 24 saat içinde ortaya çıkar ve kızarma, terleme, karın ağrısı ve ishal ile karakterizedir. Geç form ishal 24 saat sonra, tipik olarak tedaviden 3-10 gün sonra ortaya çıkar, şiddetli ve uzun süreli olabilir ve dehidrasyona ve elektrolit dengesizliğine yol açabilir. Hastaların yaklaşık %10'unda derece 3/4 ishal görülse de, hastaların %60'a kadarı ishalin bazı yönlerini yaşayabilir. Anoreksiya, mide bulantısı ve kusma genellikle hafiftir ve dozla ilişkilidir.
Yan Etki 3
Aşırı duyarlılık infüzyon reaksiyonları.
Yan Etki 4
Mide bulantısı ve kusma.
Yan Etki 5
Yorgunluk ve iştahsızlık.
Yan Etki 6
Alopesi (saç dökülmesi).
Chu, Edward; DeVita Jr., Vincent T.. Physicians' Cancer Chemotherapy Drug Manual 2022. Jones & Bartlett Learning.






