Sacituzumab Govitecan-Hziy, Üçlü Negatif Meme Kanseri Tedavisinde FDA Onayı Aldı
22 Nisan 2020 tarihinde, ABD Gıda ve İlaç İdaresi (FDA), metastatik hastalık için en az iki basamak tedaviyi alan üçlü negatif meme kanserli hastalar için sacituzumab govitecan-hziy (Trodelvy) adlı ilaca hızlandırılmış onay verdi.
Hücre zarında östrojen hormon reseptörü (ER), progesteron hormon reseptörü (PR) ve human epidermal büyüme faktörü reseptörü 2 (HER2) adlı üç reseptörün bulunmadığı meme kanserine üçlü (triple) negatif meme kanseri denir. Tüm meme kanserlerinin %15 kadarını oluşturur.
Sacituzumab Govitecan-Hziy Etki Mekanizması Nasıldır?
Kanser hücresinde kalsiyuma bağlı sinyal ileti yolunu aktifleyen Trop-2 isimli bir protein bulunmaktadır. Trop2’nin aktifleşmesi hücre içine büyüme sinyallerinin yollanmasına neden olur. Sacituzumab govitecan-hziy, üçlü negatif meme kanserinde yeni bir hedefe yönelik tedavi olarak değerlendirilerek bu proteine karşı geliştirlen antikor-ilaç birleşiminden oluşan bir ilaçtır.
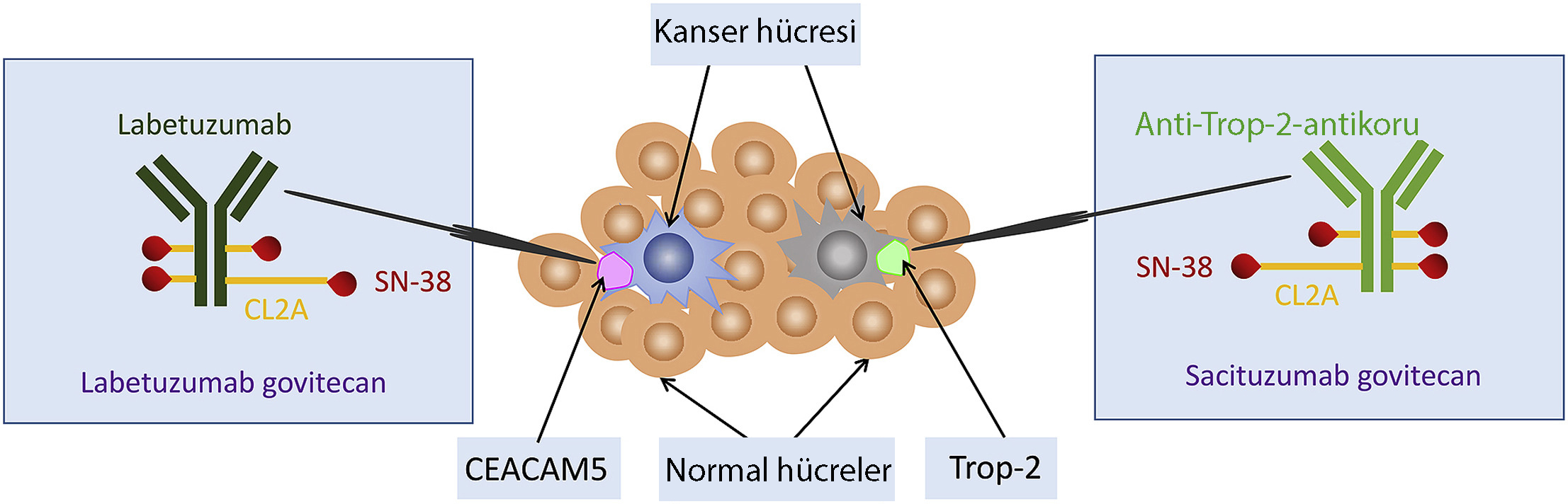
Bu alanda araştırılan iki konjuge ilaçtan birisi olan ve Trop2 yolunu baskılayan sacituzumab onay aldı.
IMMU-132-01 Çalışması
Sacituzumab govitecan-hziy'in etkinliği, metastatik hastalık için en az iki basamak tedavi uygulanmış metastatik üçlü negatif meme kanseri (metastatik triple nagatif meme kanseri, mTNBC) olan 108 hastayı kaydeden çok merkezli, tek kollu bir çalışma olan IMMU-132-01 adlı çalışmada gösterilmiştir. Bu çalışma daha önce 2016 San Antonio Meme Kanser Sempozyumu’nda sunulmuştu. Hastalara her 21 günde bir 1 ve 8. günlerde intravenöz olarak 10 mg / kg sacituzumab govitecan-hziy verildi. Tümör görüntüleme tedaviye yanıt 8 haftada bir değerlendirildi ve hastalar hastalık progresyon gösterene (ilerleyene) veya yan etkiler nedeniyle tedaviye karşı toleranssız olana kadar tedavi edildi.
Birincil etkinlik sonuç ölçütleri, genel yanıt oranı olarak değerlendirilmiştir. Çalışmadan ölçülen genel yanıt oranı % 33.3'tü (95% CI: 24.6, 43.1). Ortanca yanıt süresi 7.7 aydı (% 95 GA: 4.9, 10.8).
En yaygın yan etkiler (hastaların ≥% 25'i) bulantı, nötropeni, ishal, yorgunluk, anemi, kusma, alopesi (saç dökülmesi), kabızlık, döküntü, iştah azalması ve karın ağrısıdır. Sacituzumab govitecan-hziy ayrıca ciddi nötropeni ve ishale neden olabilir.
Önerilen sacituzumab govitecan-hziy dozu, hastalık ilerlemesine veya kabul edilemez toksisiteye kadar her 21 günde bir 1 ve 8. günlerde intravenöz infüzyon ile uygulanan 10 mg / kg'dır.
Sacituzumab govitecan-hziy, üçlü negatif meme kanseri için, genel yanıt oranı ve yanıt süresine göre hızlandırılmış onay altında onaylanmıştır. Bu endikasyon için sürekli onay, doğrulayıcı çalışmalarda klinik yararın doğrulanması ve tanımlanmasına bağlı olabilir.
FDA grants accelerated approval to sacituzumab govitecan-hziy for metastatic triple negative breast cancer.
fda.gov - 22 April 2020.