Ürotelyal (mesane-idrar yolu) kanser için sacituzumab govitecan FDA onayı aldı
13 Nisan 2021'de FDA (ABD Gıda ve İlaç İdaresi), daha önce platin içeren bir kemoterapi ve immünoterapi sonrası kanseri kötüye gitmiş, lokal ileri veya metastatik evre ürotelyal (mesane ve idrar yolu) kanserli hastalar için sacituzumab govitecan (Trodelvy, Immunomedics Inc.) adlı ilaca hızlandırılmış onay verdi.
Sacituzumab govitecan etki mekanizması nasıldır?
Kanser hücresinde kalsiyuma bağlı sinyal ileti yolunu aktifleyen Trop-2 isimli bir protein bulunmaktadır. Trop-2’nin aktifleşmesi hücre içine büyüme sinyallerinin yollanmasına neden olur. Sacituzumab govitecan, kanser tedavisinde "yeni bir hedef"e yönelik tedavidir ve bu proteine karşı geliştirlen antikor-ilaç birleşiminden oluşan bir ilaçtır.
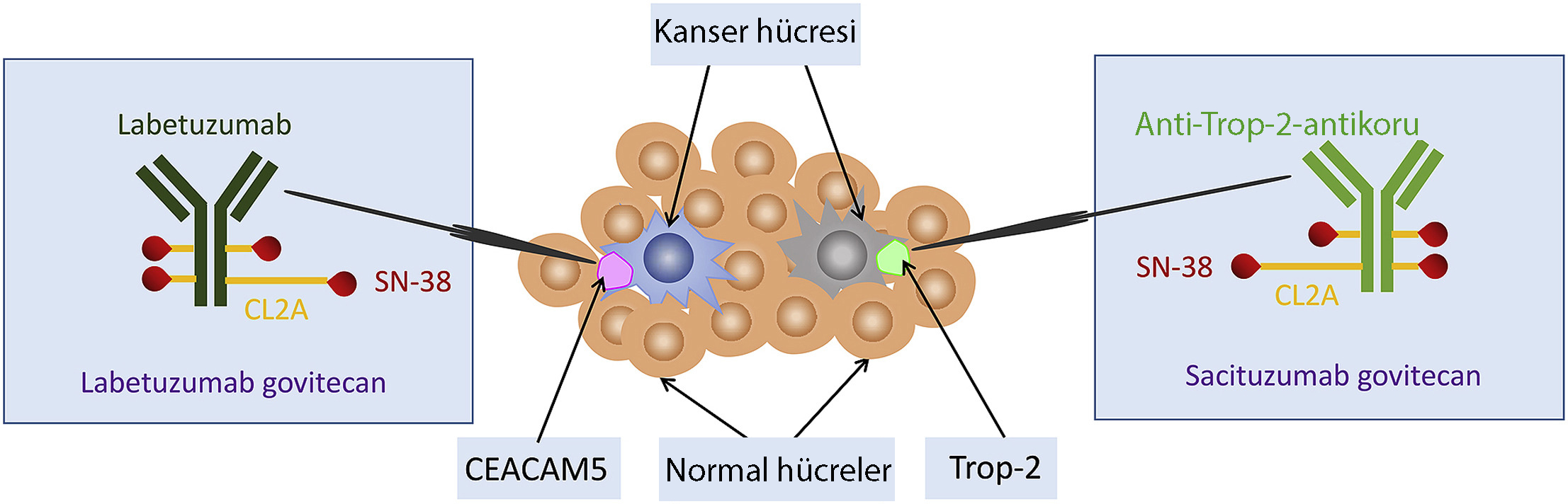
Bu alanda araştırılan iki konjuge ilaçtan birisi olan ve Trop2 yolunu baskılayan sacituzumab, ilk olarak Nisan 2020'de üçlü negatif meme kanseri tedavisi için FDA onayı almıştı.
FDA onayı getiren TROPHY klinik çalışması
Sacituzumabın mesane-idrar yolu kanserinde etkinliği ve güvenliği, bölgesel olarak ilerlemiş veya metastatik kanserli 112 hastanın dahil edildiği tek kollu ve çok merkezli TROPHY adlı klinik araştırmadan değerlendirildi. Hastalar daha önce platin-içeren kemoterapi ve PD-1 veya PD-L1 inhibitörü sınıfından immünoterapi almıştı. Hastalar, her 21 günde bir olan tedavi döngülerinin 1. ve 8. günlerinde 10 mg/kg dozunda sacituzumab govitecan aldı.
Çalışmanın ana etkililik sonlanım noktaları objektif yanıt oranı ve yanıt süresi olup, RECIST 1.1 kriterleri kullanılarak bağımsız inceleme ile değerlendirilmiştir.
Sonuçlar
- Doğrulanan objektif yanıt oranı % 27,7 idi;
- tam yanıt % 5,4 ve
- kısmi yanıt % 22,3 (% 95 CI: 19,6, 36,9).
- Tedaviye yanıt veren 31 hasta için ortanca yanıt süresi 7.2 aydı.
Yan etkiler
Sacituzumab govitecan alan hastalarda en sık (> % 25) görülen yan etkiler nötropeni, bulantı, ishal, yorgunluk, alopesi, anemi, kusma, kabızlık, iştah azalması, döküntü ve karın ağrısıdır.
Doz
Önerilen sacituzumab govitecan dozu, hastalık progresyonuna veya kabul edilemez toksisiteye kadar 21 günlük tedavi siklusunun 1. ve 8. günlerinde haftada bir kez 10 mg / kg'dır.
FDA grants accelerated approval to sacituzumab govitecan for advanced urothelial cancer.
fda.gov 13 April 2021