İlk olarak mide kanseri tedavisi için bir immünoterapi ilacı FDA onayı aldı
22 Eylül 2017 tarihinde Amerikan Gıda ve İlaç Dairesi FDA, tümörleri PD-L1 yönünden pozitif olan, tekrarlayan lokal ileri veya metastatik, mide veya mide-yemek borusu bileşke kanserli hastalar için kanser immünoterapisi pembrolizumaba (piyasa adı Keytruda) hızlandırılmış onay verdi. İlk olarak mide kanseri için bir immünoterapi ilacı FDA onayı almış oldu.
Mide (gastrik) ve mide-yemek borusu (gastroözofageal) bileşkesinde görülen kanserlerin çoğu adenokarsinom hücre tipindedir. Kanser, en iç tabaka olan mukozayı oluşturan hücrelerde başlar. Daha az görülen diğer mide kanseri alt türleri (gastrointestinal stromal tümörler, lenfoma ve karsinoid tümörler gibi) mutlaka kendi isimleri ile anılır ve mide kanseri denildiğinde aksi belirtilmezse kastedilen mide adenokarsinomudur.
Bu gastrik veya gastroözofageal bileşke adenokarsinomlu hastalarda immünoterapi kullanması için, daha önce fluoropirimidin ve platin içeren kemoterapi ve uygunsa HER2 hedefli tedavi de dahil olmak üzere iki veya daha fazla sistemik tedavi almış olma şartı koşuldu.
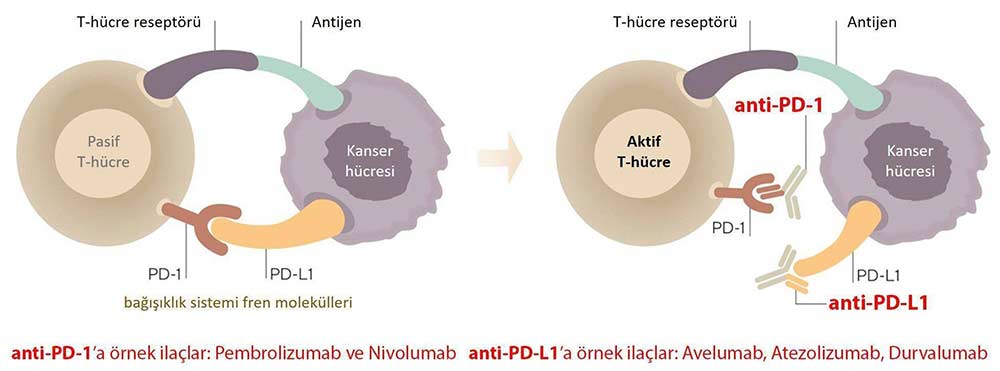
Kanserde immünoterapileri, klasik kemoterapilerden farklı olarak direk kanserli hücreyi öldürmez, bağışıklık sistemini kanserle savaşmak üzere tetikler, güçlendirir ve yeniden düzenler.
Onay, açık etiketli, çok merkezli, karşılaştırma yapmayan, çoklu kohort araştırması olan ve mide veya mide-yemek borusu bileşke adenokarsinomlu 259 hastayı içeren KEYNOTE 059 çalışması sonuçlarına dayanmaktadır. 259 hastanın % 55'i PD-L1 pozitif veya mikroasitelite kararlı (MSS) veya belirlenemeyen mikrosatellit instabilitesi (MSI) veya uyuşmazlık onarımı (MMR) durumundaki tümörler vardı.
PD-L1 pozitif olan ve MSS veya MSI veya dMMR saptanamayan 143 hasta için tedaviye objektif cevap oranı % 13.3 idi. Hastaların % 1.4'ü tedaviye tam yanıt ve % 11.9'u kısmi yanıt verdi. Yanıt veren 19 hastanın yanıt süresi 2.8 ila 19.4 ay arasında değişmekte olup, 11 hastada (% 58) 6 ay veya daha uzun yanıt süreleri ve 5 hastada (% 26) 12 ay veya daha uzun yanıt süreleri bulunmaktadır.
KEYNOTE 059'a kayıtlı 259 hastanın 7'sinde (% 3) MSI yüksek olduğu tespit edilen tümörler vardı. Bu 7 hastanın 4'ünde yanıt gözlendi (biri tam yanıt). Yanıt süresi, 5.3 ila 14.1 ay arasında değişiyordu.
PD-1'in PD-L1 ile etkileşmesini engelleyen ve anti-PD-1 sınıfından bir kanser immünoterapisi olan pembrolizumab verilen mide kanseri hastalarında görülen yan etkiler, daha önce tanımlanan immünoterapi yan etkilerine benzerdi. En sık halsizlik, kas iskelet sistemi ağrısı, iştah azalması, döküntü, ishal, mide bulantısı, kızarıklık, ateş, öksürük, nefes darlığı (dispne) ve kabızlık gözlendi.
Mide kanseri için önerilen pembrolizumab dozu, hastalığın ilerlemesi, kabul edilemez yan etkiler gelişinceye kadar her 3 haftada bir 30 dakika boyunca intravenöz infüzyon (toplardamardan serumla) 200 mg’dır. Kanseri ilerlemeyen hastalarda 24 aya kadar uygulanır.
Bu onayla aynı gün FDA, pembrolizumab tedavisine uygun mide kanserli hastaları seçmek için PD-L1 IHC 22C3 pharmDx adlı testi de onayladı. PD-L1 yönünden test edilen eski bir doku örneğinin pozitif çıkmaması halinde, FDA mümkünse yeni bir tümör biyopsisi alınmasını önerdi.
FDA grants accelerated approval to pembrolizumab for advanced gastric cancer.
fda.gov






