Kanseri Tamamen Yok Eden Tedavi Haberinin Aslı: Kaspazdan Bağımsız Apopitoz!
Kanser tedavilerinin çoğunluğu, kanser hücrelerini apopitoz yoluyla ortadan kaldırmayı amaçlar. Programlı hücre ölümü olarak da bilinen apopitoz, kaspaz proteinlerinin aktive olması sonucu meydana gelir. Ancak zamanla kanser tedavilerine direnç gelişebilmektedir. Bu da kanserin tekrarlaması ve daha kötüye gitmesiyle sonuçlanmaktadır. Son zamanlarda hücre ölüm mekanizmalarının kanser hücrelerindeki etkisi daha detaylı bir şekilde araştırılmaktaydı. Nature Cell Biology'de yayımlanan son çalışma, kaspazdan bağımsız hücre ölümünün (CCID), kanserli hücreleri ortadan kaldırmada etkili olduğunu göstermiştir.
İskoçya Glasgow Üniversitesi’nden araştırmacılar kalın bağırsak kanseri hücrelerinde kaspazdan bağımsız hücre ölümünün etkili olup olmayacağını araştırmaya çalışmışlardır.
Araştırma Sonuçlarına Göre;
- Araştırmacılar, mitokondrinin zar yapısını bozarak NF-κB proteinini aktive ederek, kaspazdan bağımsız hücre ölümünü sağlamıştır.
- Laboruvar Ortamında, CCID yoluyla kanser hücrelerinin tamamına yakını yok edilmiştir. - Bu yöntemin klasik apopitoza göre, daha fazla inflamasyona neden olduğu ve böylelikle bağışıklık sistemini daha fazla aktive ettiği gözlemlenmiştir.
Peki Bu Çalışma Klinik Açıdan Ne İfade Ediyor?
- Kanser hücrelerini yok etmede daha etkili olabilecek bir yöntem keşfedildi. CCID adı verilen bu yöntem apoptoza göre bağışıklık sistemini daha fazla aktive ediyor. Bir başka deyişle, bu yöntem bağışıklık sistemini aktive ederek kanser hücrelerine daha etkili saldırmasını sağlayabilir.
- Bu çalışma yan etkisi oldukça düşük kanser tedavilerinin önünü açabilir. Sadece tümör hücrelerinde bu yöntemi aktif edecek yaklaşımlarla, tümöre özgü (spesifik) ilaçlar geliştirilebilir.
- Önemle vurgulamak gerekir ki, bu çalışma kansere kesin çözüm değildir! Bu çalışmanın özelliği kanseri etkili bir şekilde yok edecek yeni bir yöntemin keşfedilmiş olmasıdır. Aynı zamanda, bu bilgiler henüz laboratuvar ortamında alınan ilk sonuçlardır. Hayvan modelleri ve ileri analizlerle bu çalışmanın desteklenmesi gerekmektedir.
- Kanser çok sayıda genetik ve epigenetik bozukluklardan kaynaklanır. Bu yüzden kansere karşı tek bir tedavi mümkün değildir! Farklı tedavi kombinasyonları ile kanser etkili bir şekilde yönetilebilir.
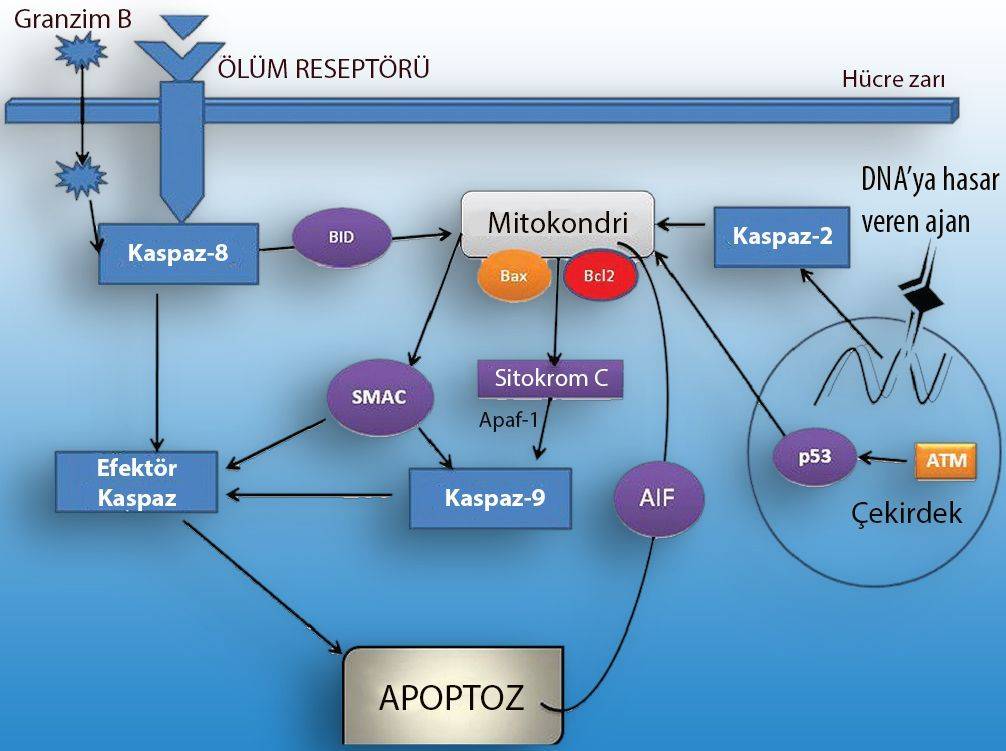
Yukarıdaki şekilde apopitoz mekanizmaları anlatılmaktadır. Ölüm reseptörüne bağlanan molekül ile aktifleşen kaspazlar, birbirilerini aktifleştirerek apoptozu başlatır. Aynı zamanda, granzim B adı verilen molekül de kaspazları direk olarak aktifleştirerek apopitoza neden olur. Kaspazlar aynı zamanda mitokondri zarının geçirgenliğini artırarak sitokrom C gibi apoptoz ilişkili proteinlerin salınmasını sağlar. Bunun sonucunda kaspazlar aktif hale gelerek apopitozu başlatır. DNA hasarlarının artması, P53 genini aktif hale getirir. P53 geni aynı şekilde mitokondrinin zarının geçirgenliğini artırarak apopitozun gerçekleşmesine neden olur.
Apopitoz Nedir? – İleri Okuma
Hem normal hücresel süreçlerde hem de kanser gibi bazı patolojik durumlarda, hücrenin çekirdeğinde bulunan DNA, hücre içindeki proteinlerin yıkımına neden olacak bazı emirler vererek hücreyi ölüme götürebilir. Apoptoza (İngilizcesi apoptosis; bazı yerlerde Türkçe'ye apopitozis olarak da çevrilmekte) uğrayan hücrelerin zarı sağlam kalır ama hücre ve parçaları, fagosit denilen bağışıklık sistemi hücreleri için çekici bir hedef haline gelmesine yol açacak değişikliklere uğrar. Ölen hücre ve parçaları, hücre içeriğinin dışarıya sızmasına zaman kalmadan, hızla ortadan kaldırıldığından apoptotik hücre ölümü inflamatuvar yanıta neden olmaz. Apoptoz bu bakımlardan, hücre zarı bütünlüğünün bozulduğu, hücrelerin sindirildiği, hücre içeriğinin dışarı sızdığı ve çoğu zaman bir iltihabi reaksiyonun oluştuğu nekrozdan farklıdır.
Patolojik Durumlarda Apoptoz: Genetik olarak değişikliğe uğramış veya onarılamayacak derecede hasar görmüş hücreler apoptoz yoluyla ortadan kaldırılır ve bu fonksiyon, şiddetli bir iltihabi reaksiyonuna yol açmaksızın yerine getirilir. Böylece, doku hasarını en düşük düzeyde tutulur.
Örneğin DNA hasarı: Güneşin zararlı ultraviyole ışınları, dokularda oksijen azlığı (hipoksi), sigara gibi karsinojenler, DNA'ya doğrudan doğruya veya serbest radikal üretimi üzerinden hasar verebilir. Onarım mekanizmaları hasarla başa çıkamazsa hücre, apoptozu başlatan mekanizmalarını harekete geçirir. Bu gibi durumlarda hücrenin yok edilmesi, hasarlı DNA'nın kanseri tetikleyecek mutasyonları oluşturması riskinden daha iyi bir seçenek olabilir. Hücreye zarar veren bu etkiler hafifse apoptoza neden olabilir, ancak aynı etkenlerin çok daha yüksek dozları, hücrenin nekroz sonucu ölmesiyle ya da kanserleşmesi ile sonuçlanabilir.
Apoptoz, istenmeyen ve onarılması olanaksız hale gelen hücrelerin, en az iltihabi reaksiyonla ortadan kaldırılmasıdır. Belirli bir düzen altında gelişir ve “programlı hücre ölümü” olarak da bilinir.
İlginizi Çekebilir:
Evangelos Giampazolias, Barbara Zunino, Sandeep Dhayade et al.
Mitochondrial permeabilization engages NF-κB-dependent anti-tumour activity under caspase deficiency.
Nature Cell Biology 2017