Karında Kansere Bağlı Sıvı (Asit) Birikimi için Avrupa İlaç Ajansı Onayı: Catumaxomab
2024 yılı Ekim ayında Avrupa İlaç Ajansı (European Medicines Agency= EMA), Lindis Biotech tarafından geliştirilen catumaxomab etken maddeli Korjuny adlı ilacı malign asit tedavisinde kullanım için onayladı. Bu onay, özellikle ileri evre kanser hastalarının hayat kalitesini artırma potansiyeli nedeniyle önemli bir adımdır.
Korjuny, standart sistemik antikanser tedavilere uygun olmayan karında asiti olan hastalarda etkili bir tedavi seçeneği olarak öne çıkıyor.
Malign asit, özellikle over (kadın yumurtalık), mide ve kolorektal kanser gibi epiteliyal kanserlerin ileri evrelerinde karın boşluğunda sıvı birikmesi olarak tanımlanır ve bu durum, hastalar için ciddi rahatsızlıklara yol açar. Karındaki asit olarak bilinen durum, karın boşluğunda sıvı birikimi olup, kimyasal bir asit değildir, sadece tıbbi terminolojide bu şekilde adlandırılır.
Catumaxomab: Trifonksiyonel Antikorun Gücü
Korjuny’nin etken maddesi olan catumaxomab, bir monoklonal bispesifik trifonksiyonel antikordur. Bu molekül, tümör hücrelerindeki epitel hücre adhezyon moleküllerini (EpCAM) ve bağışıklık sistemi hücrelerindeki CD3 antijenini hedefler. Catumaxomab, bu iki antijen arasındaki etkileşimi tetikleyerek, bağışıklık sisteminin kanser hücrelerine karşı bir saldırı başlatmasını sağlar. Bu, kanserle savaşta hem etkili hem de hedefe yönelik bir yaklaşım sunar.
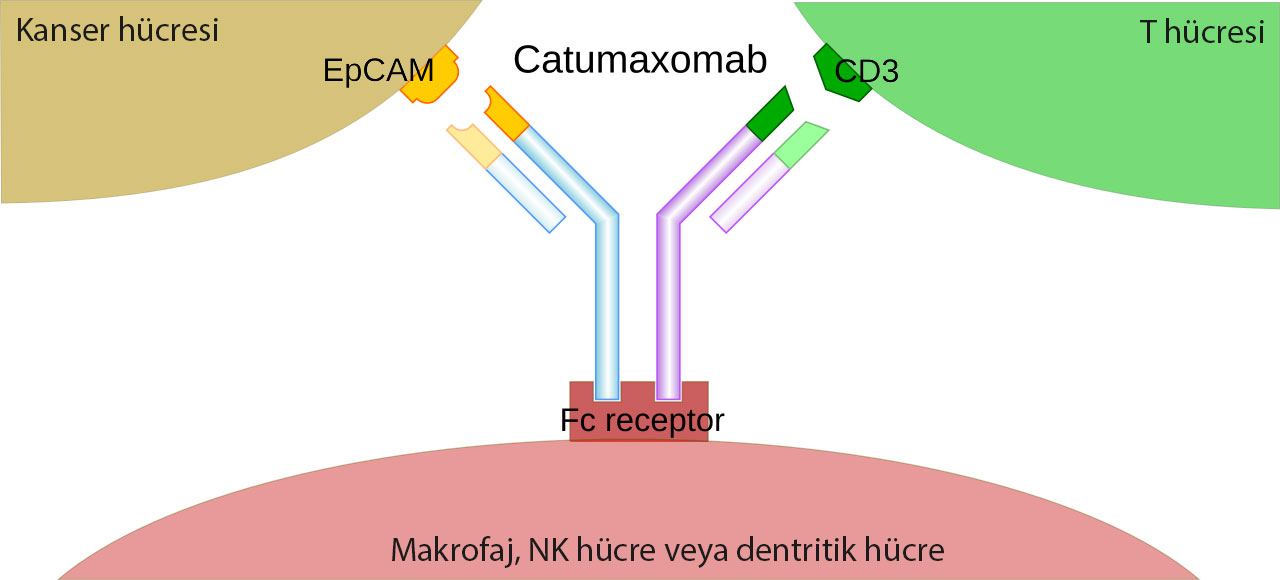
EpCAM molekülleri, tümör hücrelerinin yüzeyinde yer alır ve hücre göçü, çoğalma ve farklılaşma süreçlerinde rol oynar. Bu nedenle EpCAM’ı hedefleyen tedaviler, özellikle over (kadın yumurtalık), mide, meme ve kolorektal kanser gibi EpCAM-pozitif kanserlerde etkili olabilmektedir.
Eski Onay, Yeni Ticari Ürün
Catumaxomab, eski ticari adıyla Removab, 2009 yılında Avrupa İlaç Ajansı (EMA) tarafından EpCAM-pozitif kanserlerin neden olduğu malign asit tedavisi için onaylanmıştı. Ancak ilaç, 2013 yılında ABD pazarından ve 2017'de Avrupa pazarından ticari nedenlerle gönüllü olarak geri çekildi. Bu geri çekilmenin ana nedeni ticari beklentilerle ilgiliydi: Ürün, sınırlı bir hasta popülasyonuna hitap ediyordu ve pazarlama maliyetleri ile satışların düşük olması, ilacın ekonomik olarak sürdürülemez hale gelmesine yol açtı. Üretici firma Neovii Biotech, ilacın pazarlamasını durdurmaya ve Avrupa Komisyonu'na ilacın piyasadan çekilmesi talebini iletmeye karar verdi.
Bununla birlikte, ilacın etkinliği ve güvenliği ile ilgili bir sorun olmadığı, sadece ticari karlılık açısından yeterli performansı sağlayamadığı belirtilmektedir. İlginç bir şekilde, ilaç 2024 yılında farklı bir isimle (Korjuny) ve yeni bir üretici (Lindis Biotech) tarafından Avrupa pazarına yeniden sunulmak üzere onay aldı.
Klinik Verilerle Desteklenen Etkinlik
Korjuny, malign asit tedavisinde yalnızca sıvı boşaltma (parasentez) işlemi ile karşılaştırıldığında önemli avantajlar sunmaktadır.
Parasentez, bir doktor tarafından çoğunlukla ultrason (USG) eşliğinde gerçekleştirilen bir işlemdir. Fazla sıvıyı çıkarmak için karın içine bir iğne sokmayı içerir.

Sonuçlar
Yapılan faz 2/3 çalışmada, catumaxomab tedavisinin malign asiti olan hastalarda klinik olarak belirgin faydalar sağladığı gösterilmiştir. 258 hastanın katıldığı bu çalışmada, hastalar rastgele olarak sadece parasentez veya parasentez artı catumaxomab tedavisi olmak üzere iki gruba ayrılmıştır. Sonuçlar, catumaxomab grubundaki hastaların ponksiyon yapmadan geçirdikleri sürenin ortanca 46 gün olduğunu, bu sürenin yalnızca parasentez yapılan grupta ise 11 gün olduğunu ortaya koymuştur. Ayrıca, catumaxomab grubundaki hastalarda bir sonraki parasentez işlemine kadar geçen ortanca süre de anlamlı olarak daha uzun bulunmuştur (77 gün vs 13 gün).
Bu tedavi ile hastaların yaşam kalitesi artarken, kanserin yol açtığı karın içi sıvı birikimi ve buna bağlı belirti ve şikayetler da önemli ölçüde azalmıştır. CASIMAS adlı faz 3b çalışması, catumaxomab infüzyonlarının güvenliğini ve etkinliğini doğrulamış, ek olarak prednizolon premedikasyonu ile tedaviye bağlı yan etkilerin azaltılabileceği sonucuna ulaşmıştır.
Yeniden Kullanılabilirlik: Tedavi Döngüsü
İkinci bir faz 3 çalışması olan SECIMAS, catumaxomabın tekrar kullanımının (re-challenge) güvenli olup olmadığını araştırmıştır. İlk tedavi döngüsünden fayda gören hastalarda, catumaxomab infüzyonlarının yeniden uygulanması mümkün olmuş ve güvenli bir tedavi stratejisi olarak değerlendirilmiştir.
Yan Etkiler ve Güvenlik Profili
Catumaxomab tedavisi genellikle iyi tolere edilse de, bazı hastalarda yaygın yan etkiler görülmüştür. Bu yan etkiler arasında ateş, karın ağrısı, bulantı ve kusma gibi belirtiler yer almaktadır. Bu nedenle, tedavi öncesinde prednizolon gibi ilaçlarla ön hazırlık yapılması önerilmektedir. Ancak yapılan çalışmalar, tedavinin güvenli olduğunu ve ciddi yan etkilere yol açmadığını göstermektedir.
Sonuç: Kanserle Mücadelede Yeni Bir Alternatif
Korjuny'nin EMA tarafından onaylanması, ileri evre kanser hastalarının yaşam kalitesini iyileştirmek için önemli bir dönüm noktasıdır. Catumaxomabın etkinliği ve güvenliği klinik çalışmalarla kanıtlanmış olup, özellikle malign asit tedavisinde paracentez ihtiyacını azaltması, bu tedaviyi daha da cazip hale getirmektedir. Yeniden uygulama imkânı (re-challenge) ve kabul edilebilir güvenlik profili ile Korjuny, kanser tedavisi alanında umut verici bir seçenek olarak öne çıkmaktadır.
Bu ilaç, özellikle kemoterapi gibi sistemik tedavilere uygun olmayan hastalar için yeni bir umut ışığı sunmaktadır.
EMA Authorizes Korjuny for Malignant Ascites - Medscape - October 18, 2024.






