
Küçük hücreli akciğer kanseri tedavisinde Lurbinectedin FDA onayı aldı
15 Haziran 2020'de ABD Gıda ve İlaç İdaresi (FDA), metastatik (ileri evre) küçük hücreli akciğer kanseri tedavisinde, lurbinectedin (Zepzelca) adlı antikanser ilacı, platin-bazlı kemoterapi sonrası kanseri ilerleyen hastalarda kullanılmak üzere onayladı.
Küçük hücreli akciğer kanseri, tüm akciğer kanseri vakalarının yaklaşık %15'ini oluşturarak her yıl dünya genelinde 300 bine yakın kişiyi etkileyen agresif bir kanser türüdür. Bununla birlikte küçük hücreli akciğer kanserinde tedavi seçenekleri sınırlıdır ve son 20 yılda immünoterapiler dışında onaylanan yeni anti-kanser ilacı olmamıştı.
Lurbinectedinin küçük hücreli akciğer kanserinde etkinliği, 105 metastatik küçük hücreli akciğer kanseri hastasının katıldığı çok merkezli ve çok gruplu bir klinik çalışmada test edildi. Çalışma süresince araştırmacılar hastalara, kanserde ilerleme veya kabul edilemeyecek bir yan etki gözlenene kadar her 21 günde bir intravenöz (damardan) lurbinectedin uyguladı.
Çalışmanın ana sonlanım noktası genel yanıt oranı olarak belirlendi.
Sonuçlar
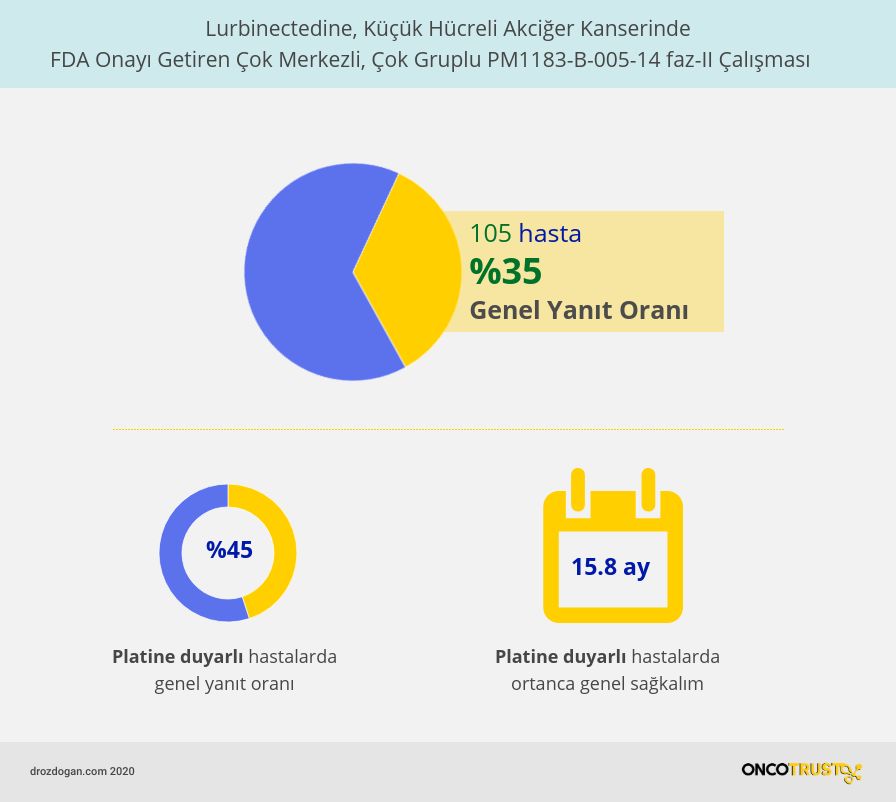
- Çalışmaya dahil edilen 105 hastada genel yanıt oranı %35 idi.
- Ortanca yanıt süresi 5,3 ay idi.
- Bağımsız gözden geçirme komitesi de genel yanıt oranını %30 ve ortanca yanıt süresini 5,1 ay olarak belirledi.
- Çalışmanın dikkat çekici bir sonucu olarak platine duyarlı hastalarda genel yanıt oranı belirgin olarak daha yüksekti: %45. Platine dirençli hastalarda ise daha düşük: %22.
- Yine bir ileri analizde, lurbinectedine objektif yanıtı olan 37 hasta arasında, ortanca genel sağkalım 1 yıldan biraz fazla (12.6 ay) idi, ancak platin duyarlı hastalığı olanlarda daha uzundur (15.8 ay); platin dirençli hastalığı olan hastalarda daha kısaydı (10.9 ay).
Laboratuvar anormallikleri de dahil olmak üzere en sık (≥%20) gözlenen yan etkiler, miyelosüpresyon (kemik iliği baskılaması), yorgunluk, kreatin, alanin aminotransferaz ve glikoz miktarında artış, bulantı, iştah azalması, kas-iskelet ağrısı, azalmış albümin, kabızlık, nefes darlığı, sodyum ve magnezyum miktarında azalma, aspartat aminotransferaz miktarında artma, kusma, öksürük ve ishaldir.
Lurbinectedin, genel yanıt oranında ve yanıt süresinde verdiği beklenmeyen olumlu sonuçlara bağlı olarak hızlandırılmış onay programı kapsamında onaylandı. Çalışma FDA’nın ‘Orbit Projesi’ kapsamında yürütüldü. Proje sayesinde, çalışmalar uluslararası ortakları ile eşzamanlı olarak sunulmakta ve değerlendirilmektedir. Avustralya Terapötik Ürünler İdaresi (TGA) ile iş birliği yapan FDA, belirlediği tarihten 2 ay önce ilacı onayladı.
Lurbinectedin nasıl anti-kanser etki gösterir?
Lurbinectedin, küçük hücreli akciğer kanseri hücrelerinin çok hızlı çoğalmasını sağlayan aşırı aktive DNA sentezine etki ederek, DNA çift ipliklerinde kırılmalara ve apoptoza (programlı hücre ölümü) yol açarak anti-kanser etki oluşturur.

Lurbinectedin, bir çeşit deniz hayvanı olan deniz fışkırtması Ecteinacidia turbinata'dan (yukarıdaki fotoğraf) izole edilen deniz bileşiği ET- 736'nın sentetik bir analogudur. Bir başka kanser ilacı olan ve sarkomların tedavisinde kullanılan trabectedin de Ecteinacidia turbinata'dan izole edilmiştir.
FDA grants accelerated approval to lurbinectedin for metastatic small cell lung cancer.
fda.gov - 15 June 2020.






