Mide ve Mide-Özofagus Bileşke Kanserinde İlk: Claudin Hedefli Zolbetuximab FDA Onayı Aldı
18 Ekim 2024'te ABD Gıda ve İlaç Dairesi (FDA), Astellas Pharma tarafından geliştirilen, claudin 18.2 (CLDN18.2) hedefli sitolitik bir antikor olan zolbetuximab-clzb (Vyloy) adlı hedefe yönelik ilacı, floropirimidin ve platin içeren kemoterapi ile birlikte, lokal olarak ilerlemiş ameliyat edilemez veya metastatik, insan epidermal büyüme faktörü reseptörü 2 (HER2) negatif mide veya mide-özofagus bileşke adenokarsinomu olan yetişkin hastaların birinci basamak tedavisi için onayladı. Bu tedavi, FDA onaylı bir test ile CLDN18.2 pozitif olduğu belirlenen tümörleri hedef alıyor.
Aynı gün FDA, mide veya mide-özofagus bileşke adenokarsinomu olan hastaları zolbetuximab tedavisine uygun olup olmadığını belirlemek için kullanılan VENTANA CLDN18 (43-14A) RxDx Assay tanı cihazını da onayladı.
Mide Kanserinin Önemi
Mide kanseri, dünya genelinde en sık teşhis edilen beşinci kanser türüdür ve son yıllarda sıklığında bir artış gözlenmektedir. Erken evrelerde genellikle az belirti gösteren bu kanser türü, çoğu zaman ilerlemiş veya metastatik (4. evre) hale geldiğinde teşhis edilir. ABD Ulusal Kanser Enstitüsü'ne göre, metastatik mide kanseri olan hastaların 5 yıllık sağkalım oranı yalnızca %7'dir. Bu bağlamda, HER2-negatif, bölgesel olarak ileri evre ve cerrahi olarak çıkarılamayan veya metastatik mide veya mide-yemek borusu bileşke adenokarsinomu olan hastalar için ilk basamak tedavi seçeneklerine olan acil ihtiyaç giderek artmaktadır.
Mide Kanseri için Yeni Bir Moleküler Hedef: Claudin 18.2
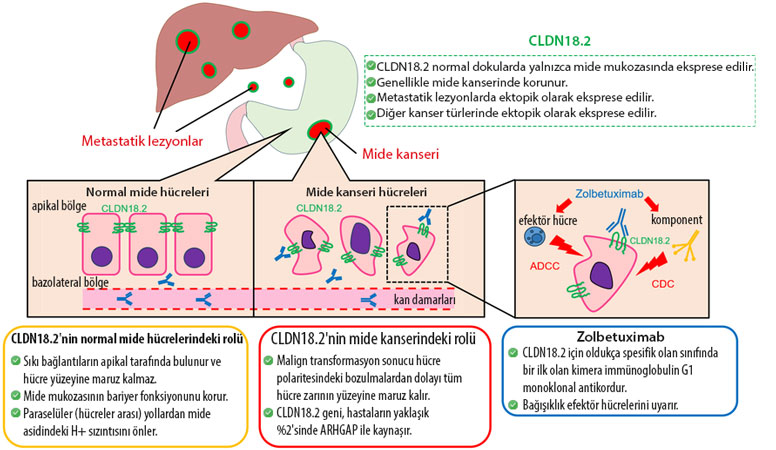
Mide kanseri ve mide-yemek borusu bileşke adenokarsinomu hastaları için mevcut olan hedefe yönelik tedavi (akıllı ilaç) seçenekleri oldukça sınırlıdır. PD-L1 proteini ifade eden tümörleri olan hastalar immünoterapi ile, HER2-pozitif tümörleri olan hastalar ise trastuzumab veya trastuzumab deruxtecan ile tedavi edilebilir. Ancak, HER2-negatif tümörleri olan hastalar, bu iki tedavi kategorisine de tam olarak uymayabilir veya hedefe yönelik tedaviler alamayabilir. Fakat bu hastalar genellikle, normalde mide mukozası hücrelerinde bulunan ve mide kanseri geliştikçe daha fazla ifade edilen CLDN18.2 seviyelerine sahiptir.
CLDN18.2 pozitifliği mide ve mide-yemek borusu bileşke (gastroözofageal bileşke) adenokarsinomlarında önemli bir biyobelirteçtir. Literatürdeki çalışmalara göre, mide ve mide-yemek borusu bileşke adenokarsinomlarının yaklaşık %30-50'si CLDN18.2 pozitif olarak tanımlanmıştır. Bu oran, CLDN18.2'nin bu kanser türlerinde potansiyel bir tedavi hedefi olarak kullanılmasını desteklemektedir.
Zolbetuximab Etki Mekanizması Nasıldır?
Zolbetuximab, Claudin-18'in isoform 2'sine (CLDN18.2) karşı geliştirilmiş deneysel bir monoklonal antikordur. Bu antikor, mide-bağırsak ve pankreas kanserlerinin tedavisi için araştırılmaktadır. 2016 yılında Astellas ilaç firması, Ganymed'i satın alarak zolbetuximabın haklarını elde etmiştir. Kasım 2021 itibarıyla, ilaç mide kanseri için faz III klinik denemelerdeydi.
GLOW ve SPOTLIGHT Çalışmaları ile Gelen FDA Onayı
Zolbetuximabın etkinliği, SPOTLIGHT (NCT03504397) ve GLOW (NCT03653507) adlı iki önemli klinik çalışma ile değerlendirildi. Her iki çalışma da CLDN18.2 pozitif, ilerlemiş, ameliyat edilemez veya metastatik HER2 negatif mide veya mide-özofagus bileşke adenokarsinomu olan hastaları içeren randomize (1:1), çift kör, çok merkezli çalışmalardı. Çalışmalarda ana etkinlik ölçütü, Bağımsız Değerlendirme Komitesi tarafından RECIST v1.1'e göre değerlendirilen progresyonsuz sağkalım (PFS) idi. Genel sağkalım (OS) ise ek bir etkinlik ölçütü olarak kullanıldı.
SPOTLIGHT çalışmasında 565 hasta, zolbetuximab-clzb ve mFOLFOX6 kemoterapisi ile plasebo ve mFOLFOX6 kemoterapisi kollarına randomize edildi. Zolbetuximab-clzb/kemoterapi kolunda ortanca progresyonsuz sağkalım 10,6 ay iken (95% CI: 8,9, 12,5), plasebo/kemoterapi kolunda bu süre 8,7 ay (95% CI: 8,2, 10,3) olarak hesaplandı (HR 0.75 [95% CI: 0.598, 0.942]; tek taraflı p-değeri = 0.0066). Genel sağkalım ise sırasıyla 18,2 ay (95% CI: 16,4, 22,9) ve 15,5 ay (95% CI: 13,5, 16,5) idi (HR 0.750 [95% CI: 0.601, 0.936]; tek taraflı p-değeri = 0.0053).
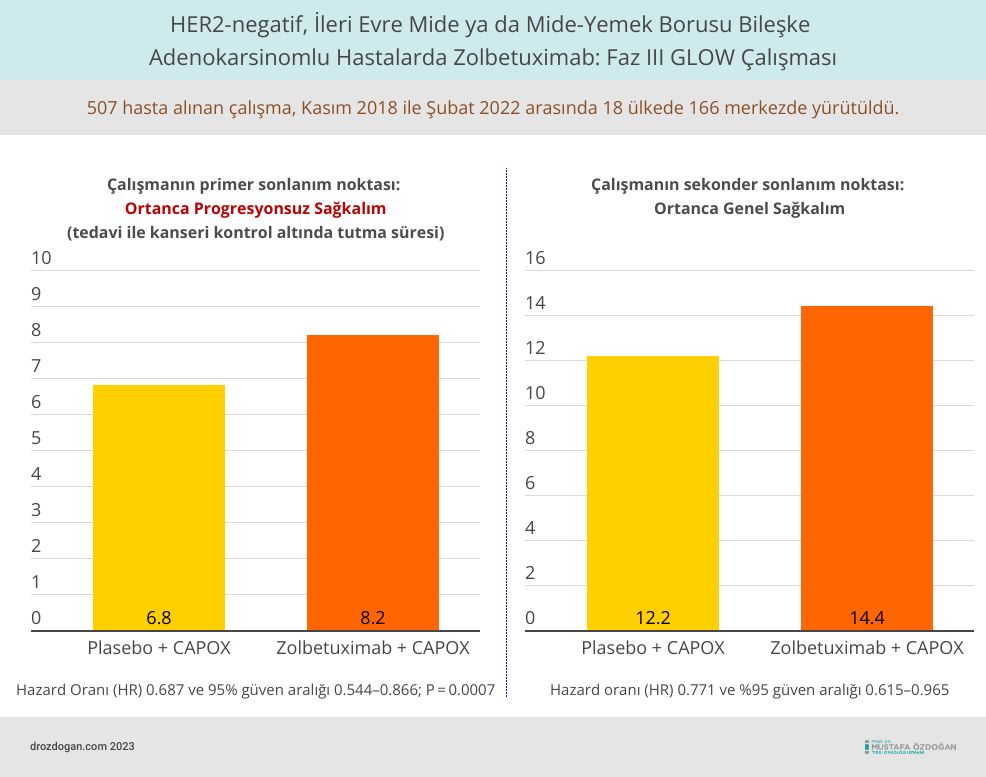
GLOW çalışmasında 507 hasta, zolbetuximab-clzb ve CAPOX kemoterapisi ile plasebo ve CAPOX kemoterapisi kollarına randomize edildi. Zolbetuximab-clzb/kemoterapi kolunda ortanca progresyonsuz sağkalım 8,2 ay (95% CI: 7,5, 8,8) iken, plasebo/kemoterapi kolunda bu süre 6,8 ay (95% CI: 6,1, 8,1) olarak hesaplandı (HR 0.687 [95% CI: 0.544, 0.866]; tek taraflı p-değeri = 0.0007). Genel sağkalım ise sırasıyla 14,4 ay (95% CI: 12,3, 16,5) ve 12,2 ay (95% CI: 10,3, 13,7) idi (HR 0.771 [95% CI: 0.615, 0.965]; tek taraflı p-değeri = 0.0118).
Yan Etkiler
SPOTLIGHT çalışmasında en sık görülen ciddi yan etkiler (≥%2) arasında kusma, bulantı, nötropeni, febril nötropeni, ishal, bağırsak tıkanıklığı, ateş, pnömoni, solunum yetmezliği, pulmoner emboli, iştah azalması ve sepsis yer aldı. GLOW çalışmasında ise en sık görülen ciddi yan etkiler (≥%2) kusma, bulantı, iştah azalması, trombosit sayısında azalma, üst gastrointestinal kanama, ishal, pnömoni, pulmoner emboli ve ateş olarak bildirildi.
Zolbetuximab Dozajı
Zolbetuximab-clzb'nin önerilen dozajı floropirimidin ve platin içeren kemoterapi ile birlikte şu şekildedir:
- İlk doz: 800 mg/m² intravenöz,
- Sonraki dozlar: 600 mg/m² her 3 haftada bir veya 400 mg/m² her 2 haftada bir intravenöz olarak uygulanır.
Bu başvuru, FDA'nın "Gerçek Zamanlı Onkoloji İnceleme" (Real-Time Oncology Review= RTOR) pilot programı kapsamında değerlendirildi ve öncelikli inceleme, hızlı onay ve yetim ilaç statüsü aldı.
FDA approves zolbetuximab-clzb with chemotherapy for gastric or gastroesophageal junction adenocarcinoma. 18 Oct 2024. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-zolbetuximab-clzb-chemotherapy-gastric-or-gastroesophageal-junction-adenocarcinoma






