Tümör Agnostik (Bağımsız) Yeni Bir Kanser İlacı Fark Yaratıyor: Trastuzumab Deruxtecan
Tümör Agnostik Nedir?
Kanserin kaynaklandığı organdan bağımsız, kanser hücresine özgü genetik değişimleri hedef alan ilaçlara tümör agnostik diyoruz. Bu şekilde onay alan kanser ilaçlarının sayısı giderek artıyor.
Tümör Agnostik Durumlar için Onay Alan Kanser İlaçları Nelerdir?
Bu amaçla ilk FDA (ABD Gıda ve İlaç İdaresi) onayı 2017 yılında MSI-H veya dMMR tümörleri olan hastalar için bir immünoterapi olan pembrolizumaba (Keytruda) verilmişti. Bu onayla tümör agnostik ilk biyobelirteç MSI-H ve dMMR durumları olmuştu.
Daha sonra 2018’da NTRK gen füzyonlarına sahip tümörler için larotrektinib (Vitrakvi) FDA onayı alarak ikinci tümör agnostik ilaç oldu. Bu sayı her yıl arttı. Sırasıyla 2019’da enterectinib (Rozlytrek), yine NTRK genetik değişimini hedef alan bir ilaç olarak onay aldı. Haziran 2020’de tümör mutasyon yükü yüksek (TMB-H) tüm solid/organ tümörlü hastalar için pemrolizumab FDA onayı aldı. Haziran 2022’de BRAF mutasyonlu tümörler için trametinib (Mekinist) ve dabrafenib (Tafinlar) kombinasyonu onay aldı. Eylül 2022’de RET füzyon pozitif tümörler için selpercatinib (Retevmo) bu listeye girdi.
Böylelikle onkolojide, tümör agnostik 5 biyobelirtecimiz (MSI-H/dMMR, NTRK’lar, TMB-H, BRAF ve RET) ve 5 farklı tedavi rejimimiz oldu. Şimdi bunlara bir yenisi daha aday: HER2 düşük ve yüksek pozitif tüm solid tümörler için bir antikor-ilaç birleşimi olan trastuzumab deruxtecan (Enhertu).
Bir Japon biyoteknoloji firması olan Daiichi Sankyo tarafından geliştirilen Enhertu şimdiye kadar;
- 2019’da daha önce en az 2 basamak anti-HER2 tedavi almış HER2 pozitif ileri evre meme kanseri,
- 2021’de daha önce tedavi almış HER2 pozitif ileri evre mide kanseri,
- Mayıs 2022’de daha önce bir basamak anti-HER2 tedavi almış HER2 pozitif ileri evre meme kanseri,
- 6 Ağustos 2022’de HER2-düşük pozitif meme kanseri için onay aldı. Böylelikle HER2-düşük pozitif kavramı ile tanışmış olduk. Enhertu HER2-düşük kanserler için onay alan ilk ilaç oldu.
- 12 Ağustos 2022’de daha önce tedavi almış HER2 pozitif ileri evre küçük hücreli dışı akciğer kanseri için FDA onayı aldı. Bu, akciğer kanserinde HER2 hedefli ilk akıllı ilaç onayıdır.
Enhertu Etki mekanizması Nasıldır?
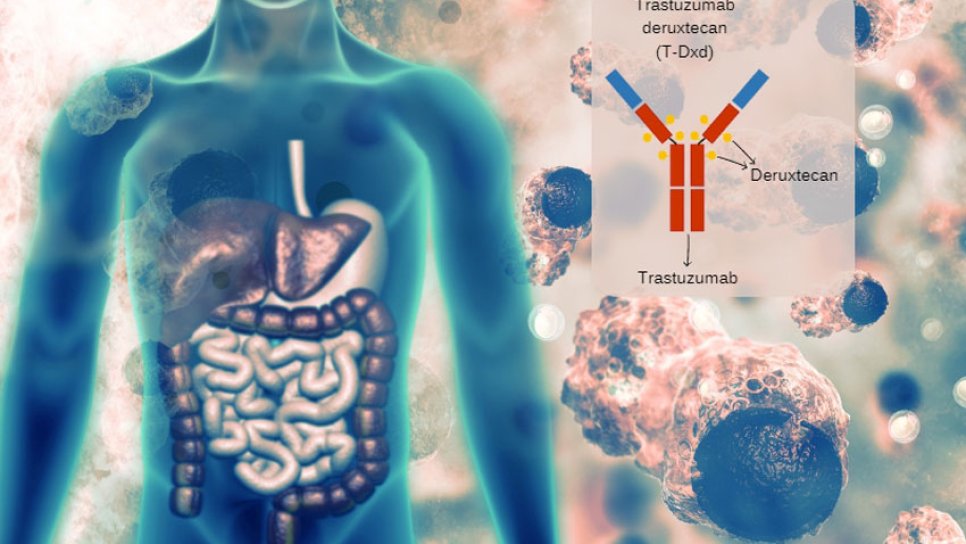
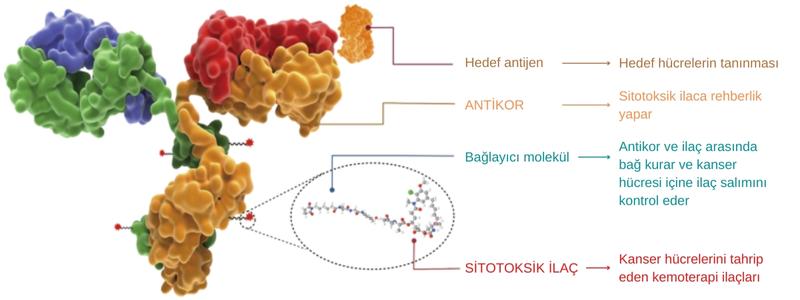
Trastuzumab deruxtecan, HER2 reseptörüne bağlanacak şekilde geliştirilen bir monoklonal antikor ve bu antikora bağlı bir kemoterapi ilacının birleşiminden oluşur. Antikor-ilaç konjugatı sınıfından yeni nesil kanser ilaçlarından biridir.
HER2, meme kanseri hücrelerinin yüzeyinde yoğun ya da az ifade edilen ve hem hastalık gidişatı hakkında fikir veren hem de akıllı ilaç hedefi olan bir reseptördür. 2000 yılı sonrası meme kanserleri HER2 pozitiflik durumuna göre sınıflandırılmaya başlanmıştır.

Mide Kanseri için Küçük ama Önemli Bir Çalışma
15 Kasım 2022’de önde gelen onkoloji dergisi Journal of Clinical Oncology’de yayımlanan bir çalışma, trastuzumab deruxtecana, HER2-düşük pozitif mide kanserinde onayın yakın olduğunu bizlere düşündürdü.
HER2-düşük Ne Demektir?
Tümör dokusu, patolog tarafından mikroskop altında incelenirken, özel immünohistokimyasal (İHK) boyamalarla, tümörün HER2 durumu tespit edilir. Artık klasikleşen yaklaşımımıza göre, İHK boyamalarda;
- 0 HER2 "negatif"
- 1+ HER2 durumu "düşük pozitif"
- 2+ HER2 durumu "şüpheli pozitif". Bu durumda doğrulama için FISH testi ile HER2 çalışılması gerekir. FISH pozitif ya da negatif saptanırsa tümörün HER2 yönünden nihai durumuna karar verilir.
- 3+ HER2 durumu ise "pozitif" kabul edilmektedir.
Trastuzumab deruxtecan (etken maddenin kısa adı T-DXd), yukarıda da belirttiğimiz üzere önceden tedavi edilmiş HER2 pozitif mide kanseri olan hastalarda FDA onayı almıştı. Fakat HER2-düşük hastalar için T-DXd'in etkinliği net değildi.
Çalışmanın Detayları
Trastuzumab deruxtecanın HER2-düşük mide veya mide-yemek borusu bileşke (GEJ) adenokarsinomunda etkinliğini ve güvenliliğini araştırmak için bu faz-II DESTINY-Gastric01 adlı klinik araştırma gerçekleştirildi.
Çalışma kapsamında bölgesel olarak ilerlemiş veya metastatik, floropirimidin ve platin dahil olmak üzere önceden en az iki rejimle tedavi edilmiş, ancak anti- HER2 tedavisi görmemiş hastalar, her 3 haftada bir intravenöz olarak T-DXd 6,4 mg/kg dozunda aldı. Çalışmanın birincil sonlanım noktası, bağımsız merkezi inceleme tarafından doğrulanan objektif yanıt oranıydı.
Sonuçlar
- Şubat 2018 ile Şubat 2019 arasında, Japonya ve Güney Kore'deki 27 kanser merkezinde 21 hasta grup 1'e (HER2 IHK 2+/FISH–) ve 24 hasta grup 2'ye (IHK 1+) kaydedildi.
- Doğrulanmış objektif yanıt oranı, grup 1 için beş kısmi yanıt %26,3 (%95 CI, 9,1 ila 51,2) ve grup 2'deki iki kısmi yanıt %9,5 (%95 CI, 1,2 ila 30,4) idi.
- Grup 1’de on üç hastada (%68,4) ve grup 2'de 12 hastada (%60.0) tümör boyutunda azalma görüldü.
- Ortanca genel sağkalım, grup 1'de 7,8 ay (%95 CI, 4,7 ila değerlenemeyen) ve grup 2'de 8,5 ay (%95 CI, 4,3 ila 10,9) idi.
- Ortanca progresyonsuz (ilerlemesiz) sağkalım sırasıyla 4,4 ay (%95 GA, 2,7 ila 7,1) ve 2,8 ay (%95 GA, 1,5 ila 4,3) idi.
- Grup 1 ve 2'de en yaygın ciddi (derece ≥ 3) tedaviyle ortaya çıkan yan etkiler anemi (%30.0 ve %29.2), nötrofil sayısında azalma (%25,0 ve %29,2) ve iştahta azalma (%20,0 ve %20,8) idi. İlaca bağlı interstisyel akciğer hastalığı/pnömoni her grupta bir hastada meydana geldi (derece 1 veya 2). Tedaviye bağlı yaşam kaybı meydana gelmedi.
Sonuç olarak bu çalışma, T-DXd'nin daha önce yoğun bir şekilde tedavi edilmiş HER2-düşük mide ve mide-yemek borusu bileşke adenokarsinomlu hastalarda klinik aktiviteye sahip olduğuna dair ön kanıt sağlamaktadır ve gelecekte bu durumdaki hastaların tedavisi için onaylanması olasıdır.
Kensei Yamaguchi, et al. Trastuzumab Deruxtecan in Anti–Human Epidermal Growth Factor Receptor 2 Treatment–Naive Patients With Human Epidermal Growth Factor Receptor 2–Low Gastric or Gastroesophageal Junction Adenocarcinoma: Exploratory Cohort Results in a Phase II Trial. Journal of Clinical Oncology. Published online November 15, 2022.