
ROS1 Mutasyonu Pozitif Akciğer Kanseri için Repotrectinib FDA Onayı Aldı
Lokal olarak ilerlemiş ileri veya metastatik ROS1 mutasyonu pozitif küçük hücreli dışı akciğer kanseri (KHDAK) için repotrectinib (Augtyro, Bristol-Myers Squibb Şirketi), 15 Kasım 2023 tarihinde, ABD Gıda ve İlaç İdaresi (FDA) onayı aldı.
Bu onay, daha önce ROS1 tirozin kinaz inhibitörü (TKİ) almış olan ROS1-pozitif KHDAK hastalarını da içeren ilk FDA onayıdır ve aynı zamanda TKİ-naiv (daha önce TKİ tedavisi görmemiş) hastaları da kapsar.
Repotrectinib Nedir, Etki Mekanizması Nasıldır?
Repotrectinib, ROS1-pozitif ve NTRK füzyon-pozitif kanserlerde kullanılan "yeni nesil" bir tirozin kinaz inhibitörüdür (TKİ). Etki mekanizması, kanser hücrelerinin büyümesini ve çoğalmasını sağlayan belirli proteinlerin aktivitesini engelleyerek çalışır. Bu proteinlerden biri ROS1 tirozin kinazıdır, ve repotrectinib bu kinazı inhibe ederek kanser hücrelerinin büyümesini durdurabilir veya yavaşlatabilir. "Yeni nesil" ifadesi, bu ilacın daha önce kullanılan TKİ’lere göre geliştirilmiş moleküler yapıya sahip olduğunu ve potansiyel olarak daha etkili olduğunu veya daha az yan etkiye neden olabileceğini ifade eder. Ayrıca, dirençli kanser hücrelerine karşı da etkili olabilecek şekilde tasarlanmıştır. Bu da, ilacın daha önce kullanılan TKİ'lar tarafından tedavi edilmeye direnç gösteren tümörleri hedef alabilmesi anlamına gelir.
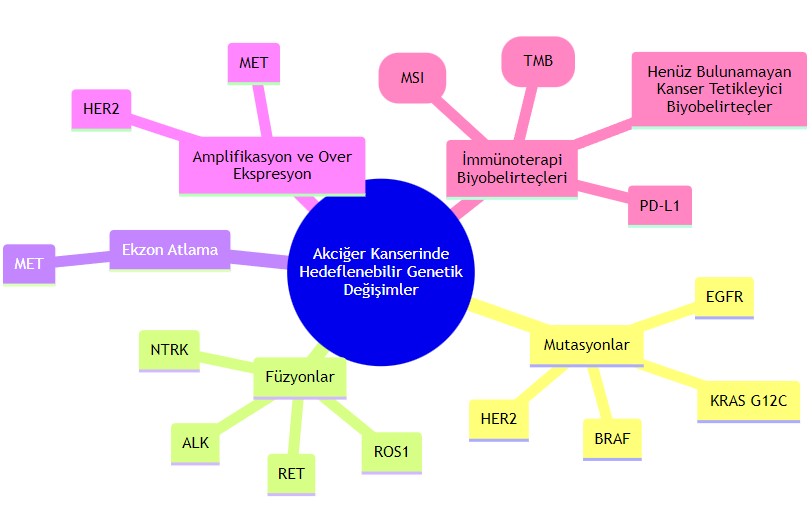
Akciğer Kanserinde ROS1'in Önemi
Akciğer kanserlerinde ROS1 translokasyonları / gen füzyonları %1 oranında bulunmaktadır. Translokasyonlar, bir gen parçasının, genin geri kalan kısmından ayrılıp DNA'daki başka bir gene girdiğinde ortaya çıkar ve ortaya bir füzyon (birleşim) geni ve bunun sonucunda bir füzyon proteini oluşur. Akciğer kanseri ilişkili ROS1 füzyonunda, genden kopan parça yine bu genin başka bir bölümüne girmektedir. ROS1 geninde füzyon meydana geldiğinde, elde edilen füzyon proteini, yani tirozin kinaz reseptörü, sürekli olarak aktif hale gelir ve kanser hücresinin sürekli büyümesi ve çoğalması için sinyaller üretir.
Aşağıda, akciğer kanserinde hedeflenebilir genetik değişimler ve tedavi yanıtını öngörebilecek biyobelirteçler özetlenmiştir:
TRIDENT-1 Çalışması ile gelen FDA Onayı
FDA onayı, lokal ileri veya metastatik ROS1-pozitif KHDAK hastalarını içeren küresel, çok merkezli, tek kollu, açık etiketli, çok kohortlu bir klinik deneme olan TRIDENT-1'e dayanıyordu.
Etkililik, daha önce bir basamak platin bazlı kemoterapi ve/veya immünoterapi almış 71 ROS1 TKİ-naiv hastada ve 1 önceki ROS1 TKİ tedavisi almış ancak platin bazlı kemoterapi veya immünoterapi almamış 56 hastada değerlendirildi.
Ana etkililik sonuç ölçütleri, genel yanıt oranı ve yanıt süresi idi.
- Önceden tedavi görmemiş grupta genel yanıt oranı %79 (95% CI: 68, 88) ve daha önce ROS1 inhibitörü ile tedavi gören hastalarda %38 (95% CI: 25, 52) idi.
- İki grup için sırasıyla ortanca yanıt süresi 34.1 ay (95% CI: 25.6, değerlendirilemez) ve 14.8 ay (95% CI: 7.6, değerlendirilemez) olarak belirlendi.
Ölçülebilir beyin metastazları olan hastalarda ve TKİ tedavisini takiben direnç mutasyonları geliştiren hastalarda yanıtlar gözlendi.
En yaygın (>20%) yan etkiler baş dönmesi, tat bozukluğu, periferik nöropati, kabızlık, nefes darlığı, ataksi, yorgunluk, bilişsel bozukluklar ve kas güçsüzlüğüydü.
Önerilen repotrectinib dozu, hastalık ilerlemesi veya kabul edilemez toksisiteye kadar günde bir kez 160 mg ağız yoluyla, yemekle veya yemeksiz olarak 14 gün süreyle alınır ve daha sonra günde iki kez 160 mg'a çıkarılır.
FDA approves repotrectinib for ROS1-positive non-small cell lung cancer. 16.11.2023 https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-repotrectinib-ros1-positive-non-small-cell-lung-cancer






