Panitumumab (Vectibix) Nedir? FDA Onayı, Türkiye Ruhsatı ve Geri Ödeme Durumu
- FDA Onaylı: Evet (İlk onay tarihi: 27 Eylül 2006)
- Kutu Adı: Vectibix
- Etken Madde Adı: Panitumumab
- Uygulama Şekli: İntravenöz
- Sınıfı: Monoklonal antikor, anti-EGFR antikoru
- Kategori: Hedefe yönelik ajan
- Üretici: Amgen
- Türkiye Dağılımı: Amgen
- Onaylı Olduğu Kanserler: FDA onaylıdır, metastatik kolorektal kanser (mKRK)
Vectibix Nedir?
Panitumumab etken maddeli Vectibix, tamamen insan yapımı bir IgG2 monoklonal antikor olup epidermal büyüme faktörü reseptörüne (EGFR) bağlanarak, hücre çoğalmasını ve kanser hücrelerinin hayatta kalmasını engellemeyi hedefler.
Wild Tip RAS Ne Demektir?
Wild tip (veya "wild type") RAS, genetik mutasyon içermeyen doğal, normal formdaki RAS genini ifade eder. RAS genleri, hücre büyümesi ve bölünmesini düzenleyen önemli sinyal yollarını kontrol eder. Ancak, mutasyonlu RAS genleri kanser gelişiminde yaygın bir rol oynar ve kanser hücrelerinde mutasyona uğramış formu sıkça görülür. Wild tip RAS, mutasyon taşımadığı için belirli kanser tedavilerine (örneğin anti-EGFR tedavileri) daha duyarlı olabilir, bu nedenle tedavi seçiminde RAS'ın wild tip ya da mutant olup olmadığı önemli bir kriterdir.
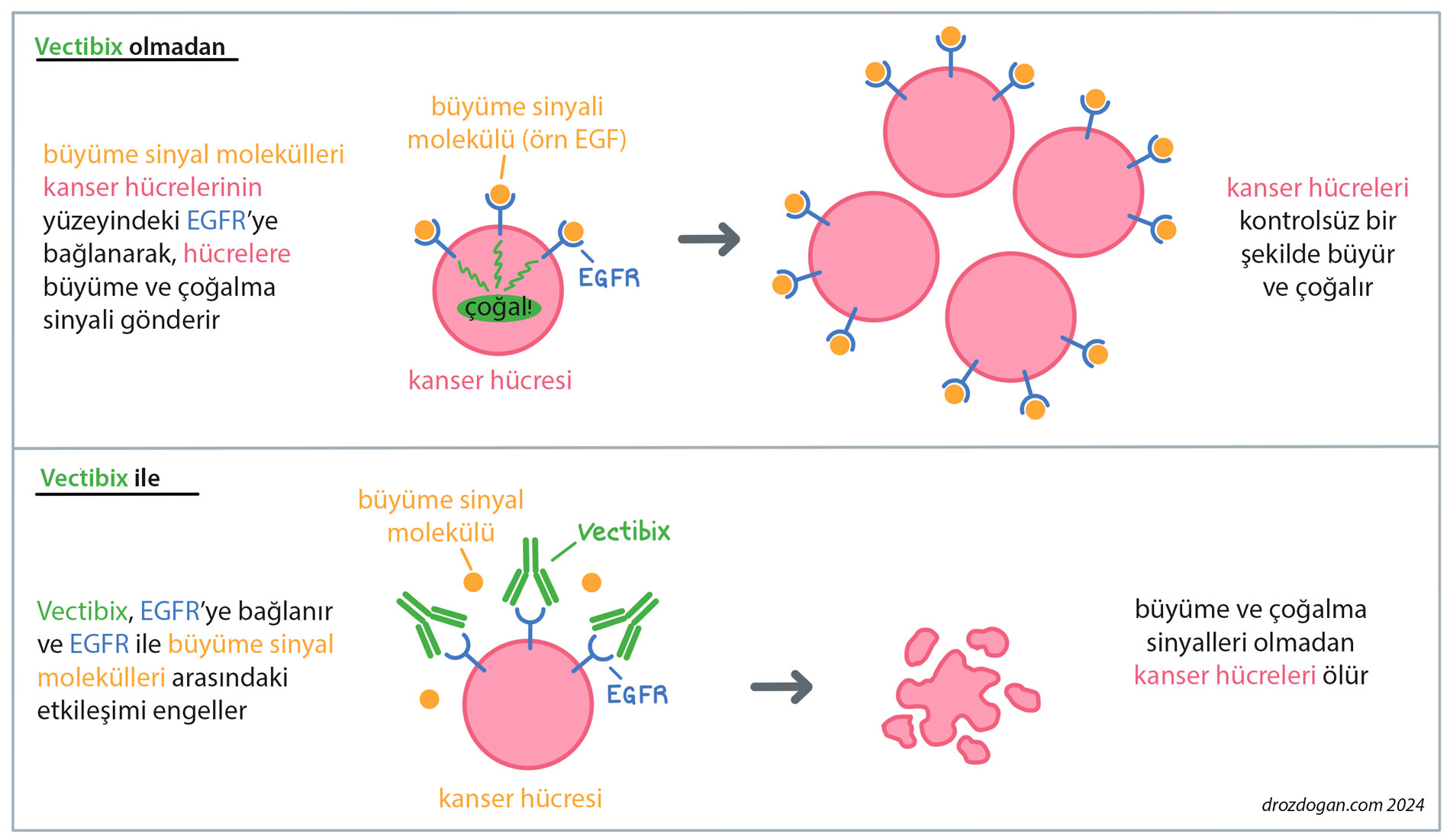
Etki Mekanizması Nasıldır?
- Panitumumab, EGFR’ye (epidermal büyüme faktörü reseptörüne) normal ligandlara göre yaklaşık 40 kat daha güçlü bir şekilde bağlanır ve bu sayede EGFR sinyallerini baskılayarak kanser hücrelerinin büyümesini engeller.
- EGFR sinyal yolağının baskılanması, hücre çoğalması, büyümesi, işgal yeteneği (invazyon/metastaz) ve kan damarlarının oluşumu (anjiyogenez) gibi kanserin yayılmasında rol oynayan önemli sinyalleri durdurur.
- Panitumumab, kemoterapi ve/veya radyasyon tedavisine yanıtı artırabilir, bu da tedavi sürecini destekler.
- Setuksimab gibi bazı diğer EGFR inhibitörlerinin aksine, panitumumabın antitümör aktivitesinde immünolojik (bağışıklık sistemi aracılı) mekanizmalar yer almaz.
- EGFR sinyallerini inhibe ederek, hücre ölümünü (apoptozis) destekleyebilir ve kanserli hücrelerin çoğalmasını daha etkili bir şekilde kontrol altında tutabilir.
FDA (ABD Gıda ve İlaç İdaresi) Onay Tarihçesi
- 27 Eylül 2006 – FDA, metastatik kolorektal kanserli hastaların tedavisi için Vectibix (panitumumab) ilacını onayladı.
- 23 Mayıs 2014 – FDA, metastatik kolorektal kanserli, KRAS wild-type hastalar için FOLFOX ile birlikte birinci basamak tedavi olarak Vectibix kullanımını onayladı.
- 29 Haziran 2017 – FDA, RAS wild-type metastatik kolorektal kanser hastaları için Vectibix (panitumumab) kullanımını onayladı.
- 16 Ocak 2025 – FDA, KRAS G12C mutasyonlu metastatik kolorektal kanser için sotorasib ve panitumumabı onayladı
Türkiye Ruhsatı
Panitumumab, daha önce panitumumab veya diğer anti-EGFR tedavileri kullanmamış, ECOG performans skoru: 0-1 olan, RAS wild tip metastatik kolorektal kanserde birinci veya ikinci seri tedavide, FOLFOX veya FOLFİRİ kombinasyon kemoterapi rejimlerinin sadece birisi ile progresyona kadar kullanımda endikedir. Progresyon durumunda veya beraberindeki kemoterapi rejiminin değiştirilmesi durumunda panitumumab veya başka bir anti-EGFR tedavisi kullanılamaz.
EGFR = epidermal büyüme faktörü reseptörü
RAS (KRAS ve NRAS) = KRAS (Kirsten sıçan sarkoma 2 viral onkogen homologu) ve NRAS (Nöroblastoma RAS viral onkogen homologu)
ECOG = Doğu Kooperatif Onkoloji Grubu (Eastern Cooperative Oncology Group)
Vectibix Geri Ödemesi Var mı?
Panitumumab, daha önce panitumumab veya diğer anti-EGFR tedavileri kullanmamış, ECOG performans skoru: 0-1 olan, RAS wild tip metastatik kolorektal kanserde birinci veya ikinci seri tedavide, FOLFOX veya FOLFİRİ kombinasyon kemoterapi rejimlerinin sadece birisi ile progresyona kadar kullanımda SGK geri ödeme kapsamına alınmıştır.
Fiyatı: Kasım 2024 itibarıyla eczane satış fiyatları şu şekildedir:
- VECTIBIX 20 MG/ML, 5 ML INFUZYON ICIN COZELTI ICEREN FLAKON (1 FLAKON) 15.830,56 ₺.
- VECTIBIX 20 MG/ML, 20 ML INFUZYON ICIN COZELTI ICEREN FLAKON (1 FLAKON) 62.835,67 ₺
Direnç Mekanizması
- EGFR’de meydana gelen mutasyonlar, panitumumaba bağlanma afinitesini azaltarak ilaca karşı direnç gelişimine yol açabilir.
- EGFR’nin hücre yüzeyindeki ifadesindeki azalma, panitumumabın etkinliğini azaltabilir ve direnci artırabilir.
- KRAS genindeki özellikle kodon 12 ve 13’teki mutasyonlar, panitumumab’a karşı direnç gelişiminde önemli bir faktördür.
- BRAF mutasyonları da panitumumaba karşı direnç oluşumunda etkili olabilir, bu mutasyonlar EGFR sinyal yolağını etkileyerek tedaviye direnç oluşturur.
- NRAS mutasyonları, hücresel sinyal iletim yollarını değiştirerek panitumumaba karşı direnç geliştirilmesine katkıda bulunabilir.
- HER2 geninde amplifikasyon yoluyla meydana gelen artış, alternatif hücresel sinyal yollarını aktive ederek panitumumaba karşı direnç oluşmasına yol açabilir.
- HER3 ifadesindeki artış, hücre büyüme sinyallerinin alternatif yollarla iletilmesini sağlayarak ilaca karşı direnci artırabilir.
- PI3K/Akt ve IGF-1R gibi alternatif hücresel sinyal yollarının aktivasyonu, panitumumab tedavisinin etkinliğini azaltarak direnç oluşumuna neden olabilir.
- lncRNA MIR100HG ve içine gömülü miRNA'lar (miR-100 ve miR-125) ifadesindeki artış, Wnt sinyalleşme yolağını aktive ederek panitumumaba karşı direnç oluşturabilir.
Emilim
Panitumumab intravenöz (IV) infüzyon yoluyla uygulanır, bu nedenle oral biyoyararlanımı bulunmamaktadır. Doğrudan kan dolaşımına verildiğinden emilim süreci oral ilaçlar gibi değildir.
Dağılım
Panitumumabın vücutta dağılımı tam olarak karakterize edilmemiştir. Ancak, farmakokinetik çalışmalarda antikorun ortalama yarı ömrünün yaklaşık 6-7 gün olduğu ve dozla birlikte doygunluğa ulaştığı belirtilmiştir.
Metabolizma
Panitumumabın metabolizması kapsamlı bir şekilde tanımlanmamıştır. Farmakokinetik çalışmalar, antikorun haftalık 2 mg/kg dozda doyuma ulaştığını göstermiştir. Yarı ömrü yaklaşık 6-7 gündür.
Doz Aralığı
- Metastatik kolorektal kanser (mCRC) için önerilen doz, her iki haftada bir IV yolla 6 mg/kg’dır.
- Alternatif bir rejim olarak, haftalık IV yolla 2.5 mg/kg dozunda uygulanabilir.
İlaç Etkileşimleri
Panitumumab ile ilgili resmi bir ilaç etkileşimi tanımlanmamıştır.
Dikkat Edilmesi Gereken Durumlar
- Setuksimab ile karşılaştırıldığında infüzyon reaksiyonları daha az görülür çünkü panitumumab tamamen insan yapımı bir antikordur.
- EGFR ekspresyon düzeyi, klinik etkinliği tahmin etmez; bu nedenle, panitumumabın klinik kullanımı için EGFR testi zorunlu değildir.
- KRAS ve NRAS testleri yapılmalıdır. Sadece “wild-type” (mutasyon olmayan) KRAS ve NRAS genlerine sahip tümörleri olan hastalar panitumumab ile tedavi edilmelidir.
- Cilt yan etkileri, panitumumabın etkisinin bir göstergesi olarak kabul edilir. Bu nedenle, cilt reaksiyonları izlenmelidir.
- Akciğer hastalığı (ILD) öyküsü olan hastalarda dikkatli kullanılmalıdır çünkü bu hastalar ILD’nin kötüleşme riski taşır.
- Cilt döküntüsü gelişen hastaların güneşten korunmaları önerilir; bu durum black-box (yüksek risk) uyarısı içerir.
- Elektrolit seviyeleri (özellikle magnezyum ve kalsiyum) tedavi sırasında ve sonrasında en az 8 hafta boyunca izlenmelidir.
- Fetüse zarar verebilir; bu nedenle, doğurganlık çağındaki kadınların tedavi sırasında ve sonrasında etkili bir doğum kontrol yöntemi kullanmaları önerilir.
Yan Etkiler
- Pruritus, kuru cilt, püstüler, akneiform cilt döküntüsü (yüz ve gövde üst kısmında). Cilt toksisitesi %90’a kadar görülebilir.
- İnfüzyona bağlı semptomlar (ateş, üşüme, ürtiker).
- Artmış öksürük, dispne, Akciğer hastalığı gelişimi.
- Hipomagnezemi.
- Diyare.
- Astenya ve genel halsizlik (%10-15 oranında).
- Tırnak yatağı iltihabı ve şişme, uzun süreli kullanımda görülür.






