FDA, KRAS G12C Mutant Kolorektal Kanserde Sotorasib ve Panitumumab Kombinasyonunu Onayladı
16 Ocak 2025'te, ABD Gıda ve İlaç Dairesi (FDA), KRAS G12C mutasyonlu metastatik kolorektal kanser (mKRK) tanısı almış, daha önce fluroropirimidin-, oksaliplatin- ve irinotekan bazlı kemoterapi görmüş yetişkin hastalar için sotorasib (Lumakras, Amgen Inc.) ile panitumumab (Vectibix, Amgen Inc.) kombinasyonunu onayladı.
FDA ayrıca, KRAS G12C mutasyonu taşıyan ve Lumakras ile Vectibix tedavisine uygun olabilecek kolorektal kanser hastalarını belirlemeye yardımcı olacak bir eş tanı cihazı olan therascreen KRAS RGQ PCR Kit (QIAGEN GmbH)'i de onayladı.
Bu gelişme, KRAS G12C mutant kolorektal kanserler için ikinci FDA onayıdır.
İLGİLİ KONULAR
- Sotorasib daha önce, KRAS G12C mutasyonlu akciğer kanseri için Mayıs 2021'de FDA onayı almıştı. Yeni onay, bu ilacın ikinci FDA onayıdır.
- 21 Haziran 2024'te FDA, KRAS G12C mutant kolorektal kanserde adagrasib (Krazati; Mirati Therapeutics, Inc.) ve setuksimab kombinasyonuna hızlandırılmış onay vermişti.
CodeBreaK 300 Çalışması ile Gelen FDA Onayı
Etkinlik ve Güvenlik Etkinlik, daha önce fluroropirimidin-, oksaliplatin- ve irinotekan bazlı kemoterapi görmüş KRAS G12C mutasyonlu mKRK hastalarında gerçekleştirilen randomize, açık etiketli, kontrollü CodeBreaK 300 çalışmasıyla değerlendirildi.
Mutasyonlar, QIAGEN therascreen KRAS RGQ PCR kiti kullanılarak tümör dokusu örneklerinden öngörülen bir şekilde tespit edildi.
Toplam 160 hasta, ya sotorasib 960 mg oral yolla günde bir kez ve panitumumab 6 mg/kg IV her 2 haftada bir, ya da araştırmacının tercihine bağlı standart bakım trifluridin/tipirasil veya regorafenib arasında randomize edildi (1:1:1).
Sonuçlar
Başlıca etkinlik sonuç ölçütü, progresyonsuz sağkalım (PFS) idi. Diğer etkinlik sonuç ölçütleri arasında genel sağkalım, genel yanıt oranı ve yanıt süresi bulunuyordu.
Çalışma genel sağkalım için istatistiksel olarak güçlendirilmedi.
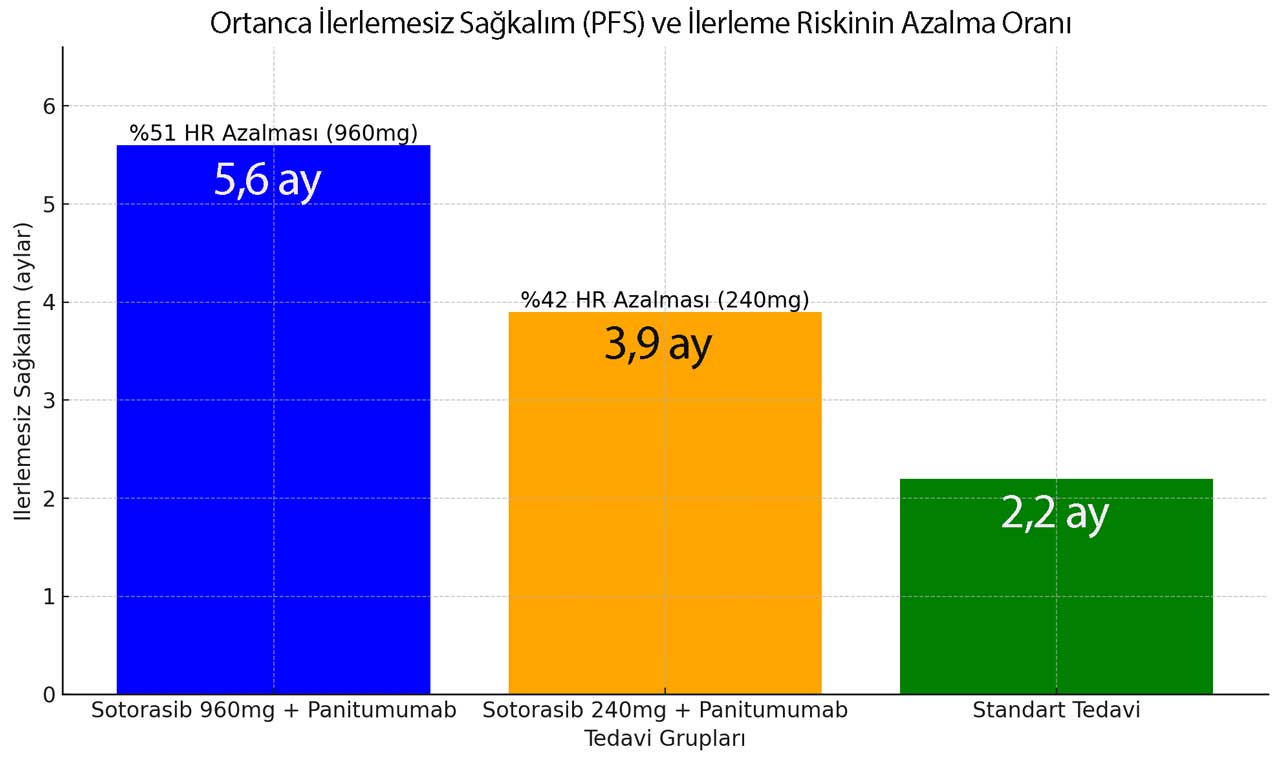
- Sotorasib 960 mg/panitumumab kolunda ortanca PFS 5.6 ay (95% CI: 4.2, 6.3) ve standart tedavi kolunda 2 aydı (95% CI: 1.9, 3.9) (hazard oranı 0.48 [95% CI: 0.3, 0.78] iki taraflı p-değeri 0.005).
- Genel sağkalımın final analizi istatistiksel olarak anlamlı değildi.
- Objektif yanıt oranı sotorasib 960 mg/panitumumab kolunda %26 (95% CI: 15, 40) ve standart tedavi kolunda %0 (95% CI: 0, 7) idi.
- Ortanca yanıt süresi, sotorasib 960 mg/panitumumab kolunda 4.4 aydı (aralık: 1.9+, 6+).
- Sotorasib 240 mg/panitumumab kolunun standart tedavi koluna kıyasla PFS için final analizi istatistiksel olarak anlamlı değildi.
Yan Etkiler
Sotorasib 960 mg/panitumumab için en yaygın advers reaksiyonlar (%20 ve üzeri) döküntü, kuru cilt, ishal, ağız yarası, yorgunluk ve kas-iskelet ağrısı idi.
En yaygın 3-4 derece laboratuvar anormallikleri arasında azalmış magnezyum, azalmış potasyum, düzeltilmiş azalmış kalsiyum ve artmış potasyum vardı.
Dozu
Önerilen sotorasib dozu, oral yolla günde bir kez 960 mg'dır. Önerilen panitumumab dozu, hastalık ilerlemesi, kabul edilemez toksisite ya da sotorasib kesilene ya da durdurulana kadar 14 günde bir IV infüzyonla 6 mg/kg'dır. İlk sotorasib dozunu, ilk panitumumab infüzyonundan önce uygulayın.






