Akciğer kanserinde MET mutasyonuna özgü ilk tedavi FDA onayı aldı: Capmatinib
6 Mayıs 2020'de, ABD Gıda ve İlaç İdaresi (FDA), 4. evre (vücudun diğer bölgelerine yayılmış) küçük hücreli dışı akciğer kanseri (KHDAK) olan yetişkin hastaların tedavisi için capmatinib (Tabrecta) adlı ilaca hızlandırılmış onay verdi. Capmatinib, MET (mezenkimal-epitelyal geçiş) ekzon 14 atlamasına yol açan genetik değişime sahip akciğer kanserli hastalar için ilk FDA onaylı tedavidir.
FDA eşzamanlı olarak capmatinib uygunluğu için MET ekzon 14 skipping (atlama) mutasyonunu saptayan FoundationOne CDx testini (F1CDx) onayladı.
Akciğer kanserleri 2 ana gruba ayrılmaktadır: küçük hücreli ve küçük hücreli dışı. Küçük hücreli dışı akciğer kanserleri de, aşağıda görüleceği üzere, çok sayıda farklı genetik ve biyolojik özelliklere sahip alt gruplara ayrılmaktadır. Her yıl, bu alt gruplarda belirleyici olan genetik değişimleri hedefleyen yeni akıllı ilaçlar geliştirilmektedir. Küçük hücreli dışı akciğer kanseri (KHDAK), tüm akciğer karserlerinin % 85-90'ını oluşturur.
Akciğer kanserleri çoğu zaman ileri evrede, yani kanser başka organlara metastaz yaptığında tanı alır. Kanser metastazı ardışık bir dizi genetik değişim sonucu oluşur ve MET ekson 14 atlama, kanserlerin metastazı için kritik bir olay olarak kabul edilir. MET ekson 14 atlamasına yol açan mutasyonlar, akciğer kanseri olan hastaların % 3-4'ünde bulunur.
Tabrecta "kinaz inhibitörü" sınıfından küçük moleküllü ve ağızdan hap şeklinde alınan bir ilaçtır; tümör hücrelerinin büyümesini durdurmaya yardımcı olan önemli bir enzimi bloke ederek işlev görür (bakınız kanser ilaç çeşitleri).
Capmatinibe (Tabrecta) FDA onayı getiren çalışma GEOMETRY mono-1
- Capmatinibin MET 14 ekzon atmala mutasyonuna sahip metastatik KHDAK'lı hastalarda etkinliği, 97 hastayı kaydeden çok merkezli, randomize olmayan, açık etiketli bir klinik çalışma olan GEOMETRY mono-1 ile gösterildi.
- Hastalar, hastalığın ilerlemesine veya kabul edilemez yan etkiye kadar günde iki kez 400 mg capmatinib aldı.
- Çalışmada ölçülmek istenen temel etkinlik sonuç ölçütü, kör bir bağımsız inceleme komitesi tarafından belirlenen genel yanıt oranı idi.
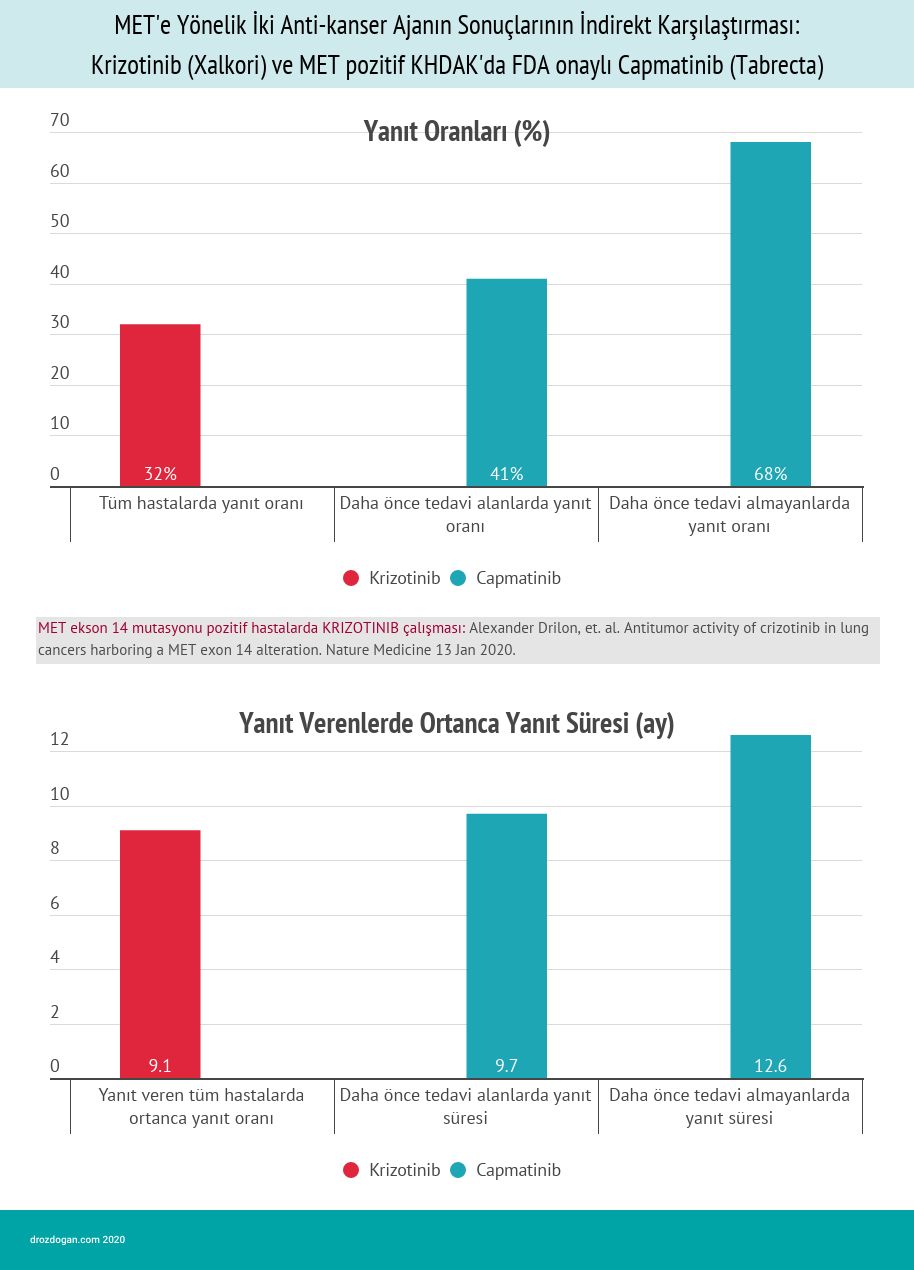
- Daha önce herhangi bir tedavi almamış 28 hasta arasında genel yanıt oranı % 68 (% 95 CI: 48, 84) idi ve yanıt süresi 12.6 aydı (% 95 CI: 5.5, 25.3).
- Daha önce tedavi edilen 69 hasta arasında genel yanıt oranı % 41 (% 95 CI: 29, 53) idi ve yanıt süresi 9.7 aydı (% 95 CI: 5.5, 13.0).
- En yaygın (hastaların en az % 20'sini etkileyen) yan etkiler periferik ödem, bulantı, yorgunluk, kusma, nefes darlığı ve iştah azalmasıdır. Capmatinib ayrıca interstisyel akciğer hastalığı, hepatotoksisite, ışığa duyarlılık ve embriyo-fetal toksisiteye neden olabilir. Hücrelerdeki erken laboratuvar çalışmalarında fototoksisite için açık bir pozitif sinyale dayanarak, hastalar güneş ışığına daha duyarlı olabilir ve capmatinib alırken cildini örtmek, güneş kremi kullanmak ve bronzlaşmamak için önlemler almaları önerilir.
- Önerilen capmatinib dozu, günde iki kez yemekle birlikte veya yemeksiz olarak 400 mg'dır.
1. FDA grants accelerated approval to capmatinib for metastatic non-small cell lung cancer.
fda.gov - 6 May 2020
2. Alexander Drilon, et. al. Antitumor activity of crizotinib in lung cancers harboring a MET exon 14 alteration. Nature Medicine 13 Jan 2020.






