Metastaz yapmamış kastrasyona dirençli prostat kanseri tedavisi için darolutamide FDA onayı aldı
30 Temmuz 2019'da, ABD Gıda ve İlaç İdaresi (FDA), metastatik olmayan kastrasyona (erkeklik hormonlarını baskılamaya) dirençli prostat kanseri tedavisi için darolutamide (Nubeqa) adlı ilacı onayladı.

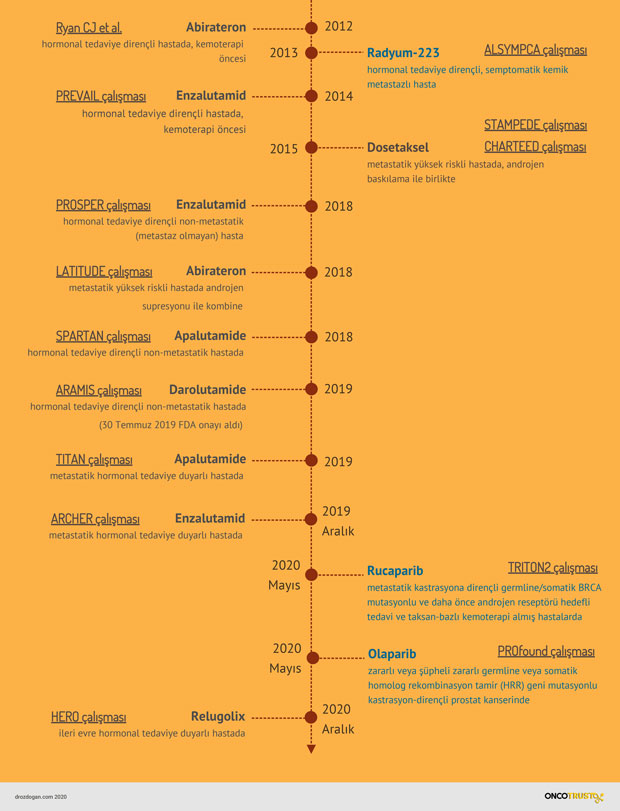
Onay, metastatik olmayan kastrasyon dirençli prostat kanseri olan 1.509 hastada çok merkezli, çift kör, plasebo kontrollü bir klinik çalışma olan ARAMIS'e dayanıyordu. Hastalar günde iki kez oral olarak (ağızdan) 600 mg darolutamid (955 kişi) veya plasebo (554 kişi) alacak şekilde 2'ye 1 oranında randomize edildi (rastgele gruplara dağıtıldı). Tüm hastalara aynı anda gonadotropin salgılayan hormon (GnRH) analoğu verildi veya daha önce bilateral orşiektomi (cerrahi kastrasyon) yapıldı. Daha önce epilepsi nöbeti öyküsü olan 12 hasta darolutamide koluna verildi.
Çalışmanın ölçmek istediği birinci sonlanım noktası, ilk uzak metastaz veya herhangi bir sebepten ölüme kadar geçen süre olarak tanımlanan metastazsız sağkalımdır.
Darolutamide ile tedavi edilen hastalar için medyan (ortanca) metastazsız sağkalım 40.4 ay iken, plasebo alan hastalar için 18.4 ay bulundu ve darolotamide kullanımı metastaz veya ölüm riskini %59 azalttı. Genel sağkalım verisi henüz olgunlaşmamıştı.
Darolutamid alan hastalarda en sık görülen yan etkiler (≥2%) yorgunluk, ekstremitede (kollar ve bacaklar) ağrı ve döküntü idi. İskemik kalp hastalığı (% 4.3) ve kalp yetmezliği (% 2.1) darolutamide kolunda daha yaygındı. Epilepsi nöbeti sıklığı iki kolda benzerdi (% 0,2).
Önerilen darolutamid dozu, gıda ile günde iki kez oral olarak verilen 600 mg'dır (iki 300 mg tablet). Hastalar aynı zamanda gonadotropin salgılayan hormon (GnRH) analoğunu almalı veya bilateral orşiektomi yaptırmış olmalıdır.