Erken Evre Akciğer Kanserinde Ameliyat Öncesi İmmünoterapi FDA Onayı Aldı
Erken evre, ameliyat edilebilir küçük hücreli dışı akciğer kanserli hastalar için, ameliyat öncesi neoadjuvan (küçültücü) tedavi olarak nivolumab (Opdivo), 4 Mart 2022'de FDA (ABD Gıda ve İlaç İdaresi) onayı aldı.
Erken Evre Akciğer Kanseri Tedavisi için En Büyük Gelişme
Bu onay, akciğer kanseri tedavisi için devrim niteliğindedir ve erken evre küçük hücreli dışı akciğer kanserinin neoadjuvan tedavisi için ilk FDA onayıdır. Aynı zamanda erken evre akciğer kanseri için ilk immünoterapi onayıdır. Bundan sonra, 4 cm ve daha büyük ve metastaz yapmamış, ameliyat edilebilir küçük hücreli dışı akciğer tümörleri için ameliyat öncesi küçültücü immüno-kemoterapi standart tedavi haline geldi.
CHECKMATE-816 Çalışması
Opdivo'nun bu durumdaki hastalardaki etkinliği, ameliyatla çıkarılabilir, Evre IB (≥4 cm), II veya IIIA küçük hücreli dışı akciğer kanseri olan hastalarda yapılan randomize, açık etiketli bir çalışma olan CHECKMATE-816'da değerlendirildi.
Bu çalışmaya EGFR veya ALK genlerinde bilinen hiçbir aktive edici genetik değişiklik olmayan hastalar dahil edildi.
Hastalar, tümör PD-L1 durumundan bağımsız olarak kaydedildi. Toplam 358 hasta, 3 haftaya kadar her 3 haftada bir uygulanan nivolumab artı platin-bazlı ikili kemoterapi veya aynı programda tek başına platin-bazlı kemoterapi almak üzere rastgele iki gruptan birine atandı.
Ana etkinlik sonuç ölçütleri, olaysız sağkalım süresi ve kör bağımsız merkezi inceleme ile değerlendirilen patolojik tam yanıt (pTY) idi.
Sonuçlar
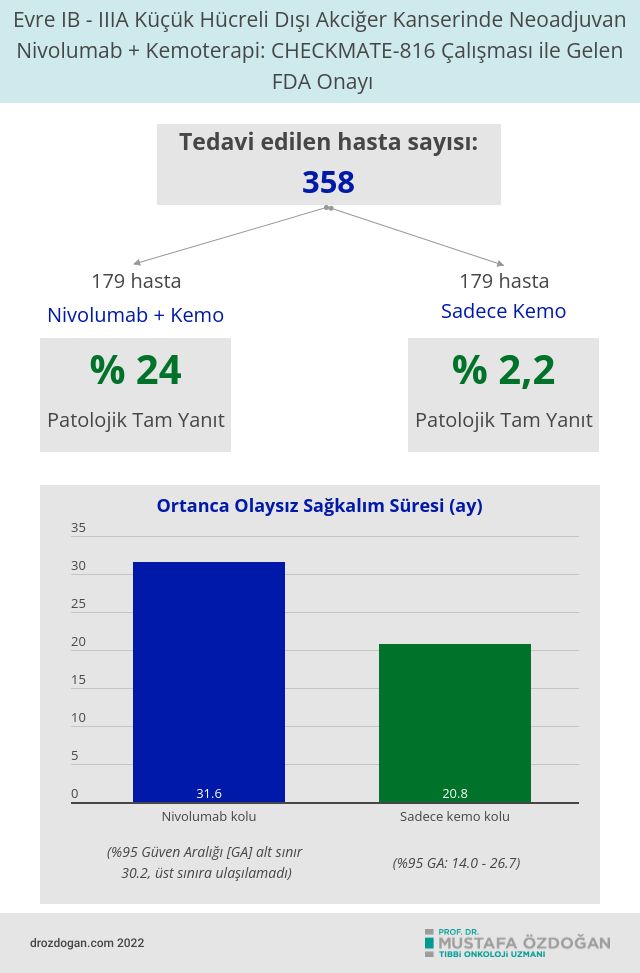
Ortanca olaysız sağkalım, nivolumab artı kemoterapi kolunda 31.6 ay (%95 Güven Aralığı [GA] alt sınır 30.2, üst sınıra ulaşılamadı) ve tek başına kemoterapi alanlar için 20.8 aydı (%95 GA: 14.0, 26.7). Kemoterapiye nivolumab eklenmesi, kanserin tekrarlaması gibi bir olayın ortaya çıkma riskini %37 azalttı.Tehlike oranı 0,63'tür (HT 0,63 GA: 0,43, 0,91; p=0,0052).
Patolojik tam yanıt oranı, nivolumab artı kemoterapi kolunda %24 (%95 GA: 18.0, 31.0) ve tek başına kemoterapi kolunda %2.2 (%95 GA: 0.6, 5.6) idi.
Hastalarda meydana gelen en yaygın (sıklığı ≥%20) yan etkiler bulantı, kabızlık, yorgunluk, iştah azalması ve döküntüdür. Kemoterapiye nivolumabın eklenmesi, ameliyatın daha sık ertelenmesine veya iptal edilmesine neden olmadı. Cerrahiyi takiben hastanede kalış süreleri ve cerrahi komplikasyon olarak tanımlanan advers reaksiyonların oranları, araştırmanın her iki kolundaki hastalar için benzerdi.
Önerilen nivolumab dozu, 3 kür için her 3 haftada bir aynı gün platin-çift kemoterapi ile 360 mg'dır.
FDA approves neoadjuvant nivolumab and platinum-doublet chemotherapy for early-stage non-small cell lung cancer. fda.gov 05 Mar 2022






