HER2 Pozitif Mide Kanseri Tedavisinde Pembrolizumab İmmünoterapisi FDA Onayı Aldı
Mide ve mide-özofagus bileşke kanserlerinin %15 ila 20'si, insan epidermal büyüme faktörü reseptörü 2'yi (HER2) kanser hücresi yüzeyinde aşırı bulundurur ki bunlara HER2 pozitif mide kanseri denir. İleri evre ve HER2 pozitif mide kanserli hastalar için bu onaya kadar standart 1. basamak tedavi, kemoterapi artı HER2’ye karşı uzun yıllardır kullandığımız trastuzumab adlı antikordur.
19 Mart 2025 Tarihli Önemli Güncelleme
19 Mart 2025'te FDA (ABD Gıda ve İlaç İdaresi), lokal ileri rezeke edilemeyen veya metastatik HER2 pozitif mide veya mide-özofagus bileşke adenokarsinomu hastalarının birinci basamak tedavisi için pembrolizumab (Keytruda) ile trastuzumab, floropirimidin ve platin içeren kemoterapi kombinasyonunu tam onay kapsamına aldı. Bu onay, tümörleri PD-L1 (CPS ≥1) eksprese eden hastalar için geçerlidir.
FDA, pembrolizumabı daha önce 5 Mayıs 2021'de hızlandırılmış onay kapsamında genel yanıt oranı sonuçlarıyla onaylamıştı. 19 Mart 2025 tarihli geleneksel onay, pembrolizumabın etkinliği ve güvenliği hakkında daha güçlü kanıtlar sağlayan KEYNOTE-811 çalışmasının nihai verilerine (genel sağkalım) dayanmaktadır.
07.11.2023 Tarihli Bir Önceki Güncelleme
7 Kasım 2023'te FDA, aynı durumdaki hastalarının birinci basamak tedavisi için pembrolizumabın mevcut endikasyonunu revize etmişti. Hızlandırılmış onay düzenlemeleri kapsamında onaylanmaya devam eden bir önceki güncellenmiş endikasyon, kullanımını FDA onaylı bir testle belirlenen tümörleri PD-L1 (CPS ≥ 1) eksprese eden hastalarla sınırlandırmıştı. Daha önce PD-L1 pozitiflik şartı bulunmuyordu.
KEYNOTE-811 Çalışması ile Gelen FDA Onayı
Onay, HER2 pozitif ileri evre mide veya mide-özofagus bileşke adenokarsinomu hastaları üzerinde gerçekleştirilen çok merkezli, randomize, çift kör, plasebo kontrollü KEYNOTE-811 çalışmasına dayanmaktadır. Çalışmaya sistemik tedavi almamış 698 hasta dahil edilmiştir. Bu hastaların 594’ü (%85) PD-L1 CPS ≥1 olan tümörlere sahipti.
Hastalar 1:1 oranında rastgele iki gruba ayrılmıştır:
-
Pembrolizumab (200 mg) veya plasebo + trastuzumab ve floropirimidin ile platin bazlı kemoterapi kombinasyonu uygulanmıştır.
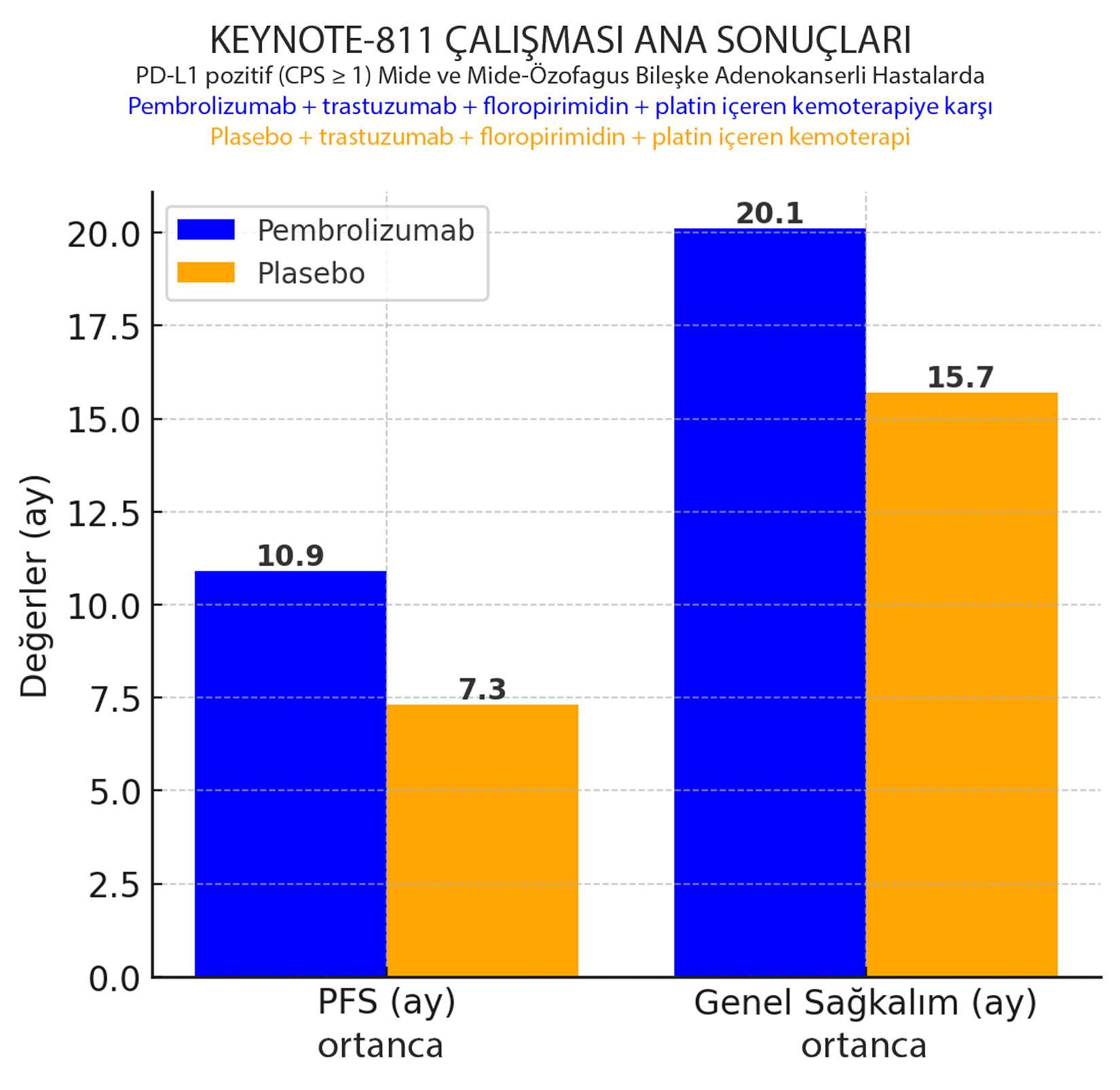
Çalışmanın ana sonuçları:
-
Ortanca progressyonsuz sağkalım (PFS):
-
Pembrolizumab kolunda 10.9 ay (95% CI: 8.5, 12.5)
-
Plasebo kolunda 7.3 ay (95% CI: 6.8, 8.4)
-
Risk oranı (HR): 0.72 (95% CI: 0.60, 0.87)
-
-
Ortanca genel sağkalım:
-
Pembrolizumab kolunda 20.1 ay (95% CI: 17.9, 22.9)
-
Plasebo kolunda 15.7 ay (95% CI: 13.5, 18.5)
-
HR: 0.79 (95% CI: 0.66, 0.95)
-
-
Genel yanıt oranı:
-
Pembrolizumab kolunda %73 (95% CI: 68, 78)
-
Plasebo kolunda %58 (95% CI: 53, 64)
-
-
Ortanca yanıt süresi:
-
Pembrolizumab kolunda 11.3 ay (95% CI: 9.9, 13.7)
-
Plasebo kolunda 9.6 ay (95% CI: 7.1, 11.2)
-
Bu veriler, pembrolizumabın trastuzumab ve kemoterapi ile kombinasyon halinde kullanıldığında genel sağkalımı ve progresyonsuz sağkalımı anlamlı ölçüde iyileştirdiğini göstermektedir.
Yan Etkiler ve Güvenlik
Çalışmada, pembrolizumab alan hastalarda gözlemlenen advers reaksiyon profili, daha önce bilinen pembrolizumab güvenlik profili ile uyumludur.
Doz
Trastuzumab ve kemoterapi ile kombinasyon halinde lokal olarak ilerlemiş rezeke edilemeyen veya metastatik HER2 pozitif mide veya GEJ adenokarsinomu olan yetişkin hastalar için önerilen pembrolizumab dozu:
-
3 haftada bir 200 mg veya
-
6 haftada bir 400 mg şeklindedir.
Bu geleneksel onay, pembrolizumabın HER2 pozitif mide kanseri tedavisindeki yerini daha da gücülendirmektedir. Klinik veriler, bu kombinasyon tedavisinin sağkalımı uzattığını ve hastalar için önemli bir fayda sağladığını ortaya koymaktadır.
FDA grants accelerated approval to pembrolizumab for HER2-positive gastric cancer.
fda.gov/ 05 May 2021