
İleri Evre Meme Kanseri Tedavisi için Capivasertib FDA Onayı Aldı
Hormon reseptörü (HR) pozitif, insan epidermal büyüme faktörü reseptörü 2 (HER2) negatif, lokal ileri veya metastatik meme kanseri olan ve en az bir endokrin bazlı tedavi rejimi sonrası metastatik ortamda ilerleme gösteren veya adjuvan terapiyi tamamladıktan sonraki 12 ay içinde nüks (tekrar) eden yetişkin, FDA onaylı bir testle tespit edilen bir veya daha fazla PIK3CA/AKT1/PTEN-değişikliği bulunan hastalar için capivasertib (Truqap, AstraZeneca Pharmaceuticals) ilacının fulvestrant ile birlikte kullanımını 16 Kasım 2023 tarihinde, ABD Gıda ve İlaç Dairesi (FDA) onayladı.
FDA, ayrıca capivasertib ile fulvestrant tedavisi için meme kanserli hastaları belirlemek üzere FoundationOne®CDx testini eşlik eden tanı cihazı olarak onayladı.
AKT yolundaki değişiklikler genellikle genetik testlerle belirlenir. Bu testler genellikle tümör dokusundan alınan bir örnekte gerçekleştirilir. Bu genetik testlerde, genellikle AKT yolunda rol oynayan belirli genlerdeki değişiklikler aranır. Bu genler genellikle PIK3CA, AKT1 ve PTEN gibi genlerdir. Bu genlerdeki mutasyonlar, AKT yolunun hiperaktivasyonuna ve sonuçta hücre büyümesi ve bölünmesinde aşırı aktiviteye neden olabilir. Bu nedenle, bu genlerdeki mutasyonlar bazen kanserin büyümesi ve ilerlemesiyle ilişkilendirilir.
Capivasertib, hücrelerin büyümesi ve bölünmesi üzerinde kontrol sağlayan AKT sinyal yolunu inhibe eden ve AstraZeneca tarafından geliştirilen küçük molekül yapısında bir ilaçtır. Bu yol, bazı kanser türlerinde aşırı aktif hale gelir ve hücrelerin kontrolsüz büyümesine ve kanserin ilerlemesine neden olabilir. Capivasertib bu yolu inhibe ederek, kanser hücrelerinin büyümesini yavaşlatır ve kanserin ilerlemesini engellemeye yardımcı olabilir.
CAPItello-291 Çalışmasıyla Gelen FDA Onayı
Faz 3, randomize, çift kör bir çalışma olan CAPItello-291'e, aromataz inhibitörü tedavisi sırasında veya sonrasında, önceki siklin-bağımlı kinaz 4 ve 6 (CDK4/6) inhibitör tedavisi ile veya olmaksızın hastalığı nüks (tekrar) eden veya ilerleyen HR pozitif, HER2-negatif ileri evre meme kanseri olan pre-, peri- ve postmenopozal kadınlar ve erkekler katıldı.
Hastalar, capivasertib artı fulvestrant veya plasebo artı fulvestrant almak üzere 1:1 oranında rastgele atandı.
Çalışmada çift birincil sonlanım noktası belirlendi: tüm hasta grubunda ve AKT yolundaki değişikliklere sahip (PIK3CA, AKT1 veya PTEN) tümörler arasında araştırmacı tarafından değerlendirilen progresyonsuz (ilerlemesiz) sağkalım.
Sonuçlar
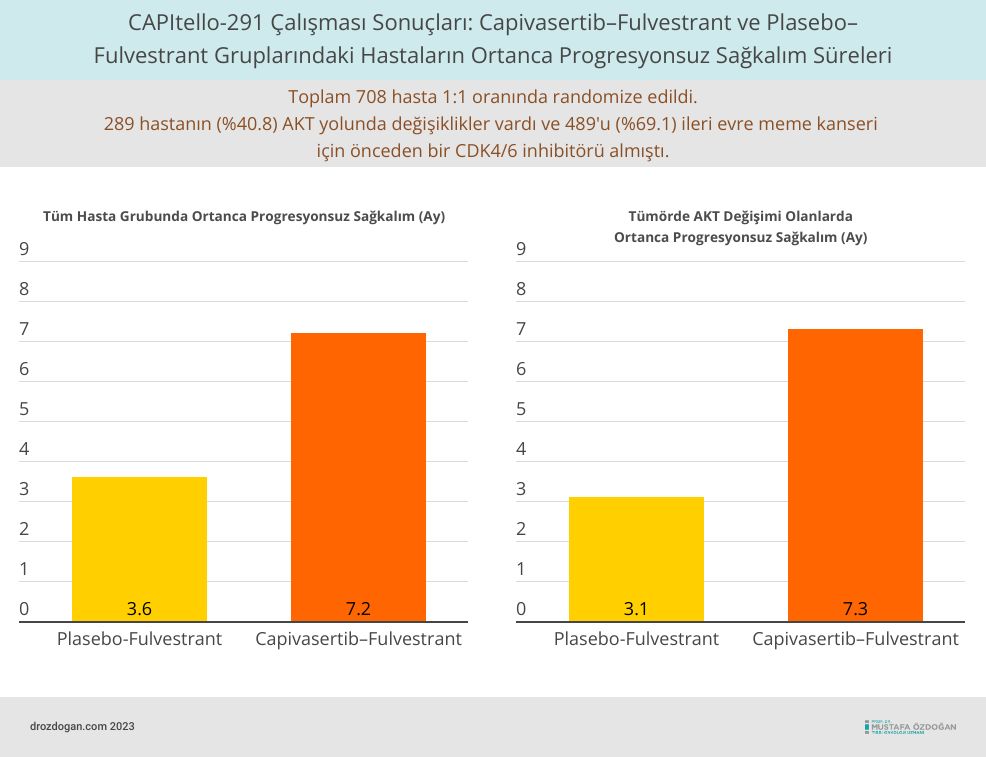
Toplamda, 708 hasta çalışmaya alındı; 289 hastanın (%40.8) AKT yolunda değişiklikler vardı ve 489'u (%69.1) ileri evre meme kanseri için önceden bir CDK4/6 inhibitörü almıştı.
- Tüm hastalar için, capivasertib–fulvestrant grubunda ortanca progresyonsuz sağkalım 7.2 ay iken, plasebo–fulvestrant grubunda 3.6 ay idi (ilerleme veya yaşam kaybı için tehlike oranı, 0.60; %95 güven aralığı [CI], 0.51 ila 0.71; P<0.001).
- AKT yolundaki değişikliklere sahip hastalar için, capivasertib–fulvestrant grubunda ortanca progresyonsuz sağkalım 7.3 ay iken, plasebo–fulvestrant grubunda 3.1 ay idi (tehlike oranı, 0.50; %95 CI, 0.38 ila 0.65; P<0.001).
Capivasertib–fulvestrant alan hastalarda, 3. derece veya daha yüksek en sık yan etkiler döküntü (%12.1'e karşı %0.3) ve ishal idi (%9.3'e karşı %0.3). Yan etkilere bağlı tedavi kesintisi oranları capivasertip kolunda %13ü plasebo kolunda ise %2.3 idi.
Önerilen capivasertib dozu, hastalık ilerlemesi veya kabul edilemez toksisiteye kadar, yemekle veya yemeksiz olarak, yaklaşık 12 saat arayla günde iki kez 400 mg, 4 gün boyunca alınıp ardından 3 gün ara verilmesidir.
*
Görselin açıklaması: Yazının görseli Microsoft Copilot tarafından şu komut ile oluşturulmuştur: "Ufka bakan bir kadının pop-art tarzında görselleştirmesi"
1. FDA approves capivasertib with fulvestrant for breast cancer. 16.11.2023. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-capivasertib-fulvestrant-breast-cancer
2. Turner NC, Oliveira M, Howell SJ, Dalenc F, Cortes J, Gomez Moreno HL, Hu X, Jhaveri K, Krivorotko P, Loibl S, Morales Murillo S, Okera M, Park YH, Sohn J, Toi M, Tokunaga E, Yousef S, Zhukova L, de Bruin EC, Grinsted L, Schiavon G, Foxley A, Rugo HS; CAPItello-291 Study Group. Capivasertib in Hormone Receptor-Positive Advanced Breast Cancer. N Engl J Med. 2023 Jun 1;388(22):2058-2070. doi: 10.1056/NEJMoa2214131. PMID: 37256976.






