Kanserde KRAS Onkoproteininin Önemi Nedir? Hücresel Sinyal Yolaklarındaki Rolü
Onkoproteinler ve Kanserde Sinyal Yolakları
Onkoprotein Nedir?
Onkoproteinler, genellikle hücre büyümesi, bölünmesi ve hayatta kalması süreçlerini düzenleyen proteinlerdir. Ancak, normal bir hücrede bu proteinlerin dengesi dikkatle kontrol edilir. Onkogen adı verilen mutasyona uğramış genler, normal hücresel proteinleri "onkoprotein" haline getirerek, hücrenin kontrolsüz bir şekilde büyümesine ve kanserleşmesine neden olabilir.
Bilinen Onkoproteinler Nelerdir?
KRAS, en sık mutasyona uğrayan onkoproteinlerden biridir.
Bunun yanı sıra, EGFR (epidermal büyüme faktörü reseptörü), HER2, MYC ve BRAF gibi proteinler de kanserlerde sıkça görülen onkoproteinler arasındadır. Her biri farklı sinyal yolaklarını aktive ederek hücrelerin kontrolsüz şekilde büyümesine katkıda bulunur.
Hücre İçi Sinyal Yolağı Nedir?
Hücre içi sinyal yolakları, hücrenin çevresinden aldığı mesajları hücre çekirdeğine ileten ve hücrenin nasıl tepki vereceğini belirleyen karmaşık protein zincirleridir. Bu yolaklar, hücrenin bölünmesini, farklılaşmasını veya programlı hücre ölümünü (apoptoz) düzenler. Sağlıklı bir hücrede bu sinyal iletimi dengede tutulur. Ancak onkoproteinlerin devreye girmesiyle, bu sinyal yolları bozulur ve hücreler aşırı büyüme veya ölümsüzlük özellikleri kazanır.
Onkoproteinlerin Keşfi ve Gelişen Araştırmalar
Onkoproteinlerin keşfi, 1970'li yıllara dayanmaktadır. Özellikle rat sarkoma (RAS) virüslerinden elde edilen RAS genlerinin ve bu genlerin hücresel versiyonlarının tanımlanması, kanser biyolojisinde çığır açmıştır. O dönemde yapılan çalışmalar, hücresel sinyal iletimi ve onkogen mutasyonları arasındaki bağlantıyı gözler önüne sermiştir. 1980’li yıllarda yapılan genetik analizlerle birlikte, EGFR, HER2 ve BRAF gibi başka onkoproteinler de keşfedilmiş ve her biri kanser tedavisinde yeni hedefler haline gelmiştir.
Bu bilgiler ışığında, KRAS gibi onkoproteinlerin kansere yol açan mekanizmalarını ve bunları hedef alan yeni tedavi yaklaşımlarını anlamak, günümüzde hem temel bilim araştırmaları hem de klinik çalışmalar için büyük bir önem taşımaktadır.
Her Yıl 3,4 Milyon RAS-mutant Kanser Tanısı Konuyor
RAS gen ailesindeki mutasyonlar, insan kanserlerinin yaklaşık %20 ila %30'unda görülmektedir. Özellikle pankreas kanserlerinde %90, kolon kanserlerinde %50 ve akciğer adenokarsinomlarında %30 oranında RAS mutasyonları saptanmıştır. Peki, RAS mutasyonlarının önemi nasıl anlaşılmıtır ve bu konuda yeni çalışmalar neler söylüyor? 15 Ocak 2025'te NEJM'de yayımlanan Dr. Piro Lito'nun "KRAS Oncoprotein Signaling in Cancer" başlıklı makalesi, bu konuda önemli ve anlaşılır bilgiler sunuyor.
KRAS Onkoproteini
Rat sarkoma virüslerinde RAS guanozin trifosfatazlarını (GTPaz) kodlayan DNA’nın keşfi ve kanser hastalarında RAS genlerinde onkojenik mutasyonların tanımlanması, RAS’ı incelemek ve terapötik olarak hedef almak için 50 yıllık bir çabayı başlattı.
Özellikle KRAS G12C adı verilen (12. kodonda glisin amino asidinin sisteine dönüşmesi) mutasyonu hedefleyen inhibitörler sayesinde akciğer, kolon ve pankreas adenokarsinomu gibi KRAS mutasyonu barındıran kanserlerde önemli ilerlemeler sağlandı. Bu ilaçların geliştirilmesi, KRAS mutasyonlarının kansere nasıl katkıda bulunduğunu daha iyi anlamamıza da yardımcı oldu.
Eski modele göre KRAS mutasyonu, hücreleri sürekli aktif bir büyüme ve bölünme sinyali ile uyarıyordu. Ancak son bulgular, KRAS’ın aslında aktif ve inaktif durumlar arasında geçiş yaptığını ortaya koyuyor. Jeffrey Klomp ve ekibi ile Jennifer Klomp ve ekibinin yaptığı iki yeni çalışma, KRAS’ın hücre büyümesini kontrol eden sinyal yollarını düşündüğümüzden farklı bir mekanizmayla etkilediğini ortaya koyuyor.
KRAS’ın Sinyal Yolu: Sadece RAF mı?
Önceki genetik çalışmalar, mutasyona uğramış RAS’ın, RAF, PI3K ve RALGDS gibi birçok farklı sinyal yolunu aktive edebildiğini öne sürüyordu. Ancak Jeffrey Klomp ve ekibinin yaptığı çalışmada pankreas adenokarsinomu modellerinde KRAS’ın sinyal çıktısı RNA dizileme ile analiz edildi. Sonuçlar, KRAS’ın etkilerinin büyük ölçüde RAF-MEK-ERK yoluyla iletildiğini gösterdi.
- RAF-MEK-ERK sinyal yolu engellendiğinde hücre çoğalması durdurulabiliyor.
- ERK’nin sürekli aktif hale getirilmesi, KRAS inhibitörlerinin tümör üzerindeki büyümeyi baskılayıcı etkisini ortadan kaldırdı.
- Buna karşılık, PI3K sinyal yolundaki AKT proteini aktif hale getirildiğinde hücre çoğalması üzerinde anlamlı bir değişiklik gözlenmedi.
Bu bulgular, mutasyona uğramış KRAS’ın tümör büyümesini sürdürmek için esas olarak RAF-MEK-ERK yoluna bağımlı olduğunu ortaya koyuyor.
Aşağıdaki figür, KRAS mutasyonlarının hücresel etkilerini ve tedavi yaklaşımlarını anlamak için önemli görsel bir rehberdir. Figürde mutant KRAS’ın farklı efektör proteinlerle etkileşimi ve sinyal çeşitliliği anlatılıyor. Panel A, geleneksel modeli açıklarken Panel B ise daha güncel ve rafine edilen modeli sunuyor. Ayrıca, “ERK’nin Çok Yönlü Etkileri” bölümünde bahsedilen ERK'nin pleiotropik etkilerini de görsel olarak destekliyor.
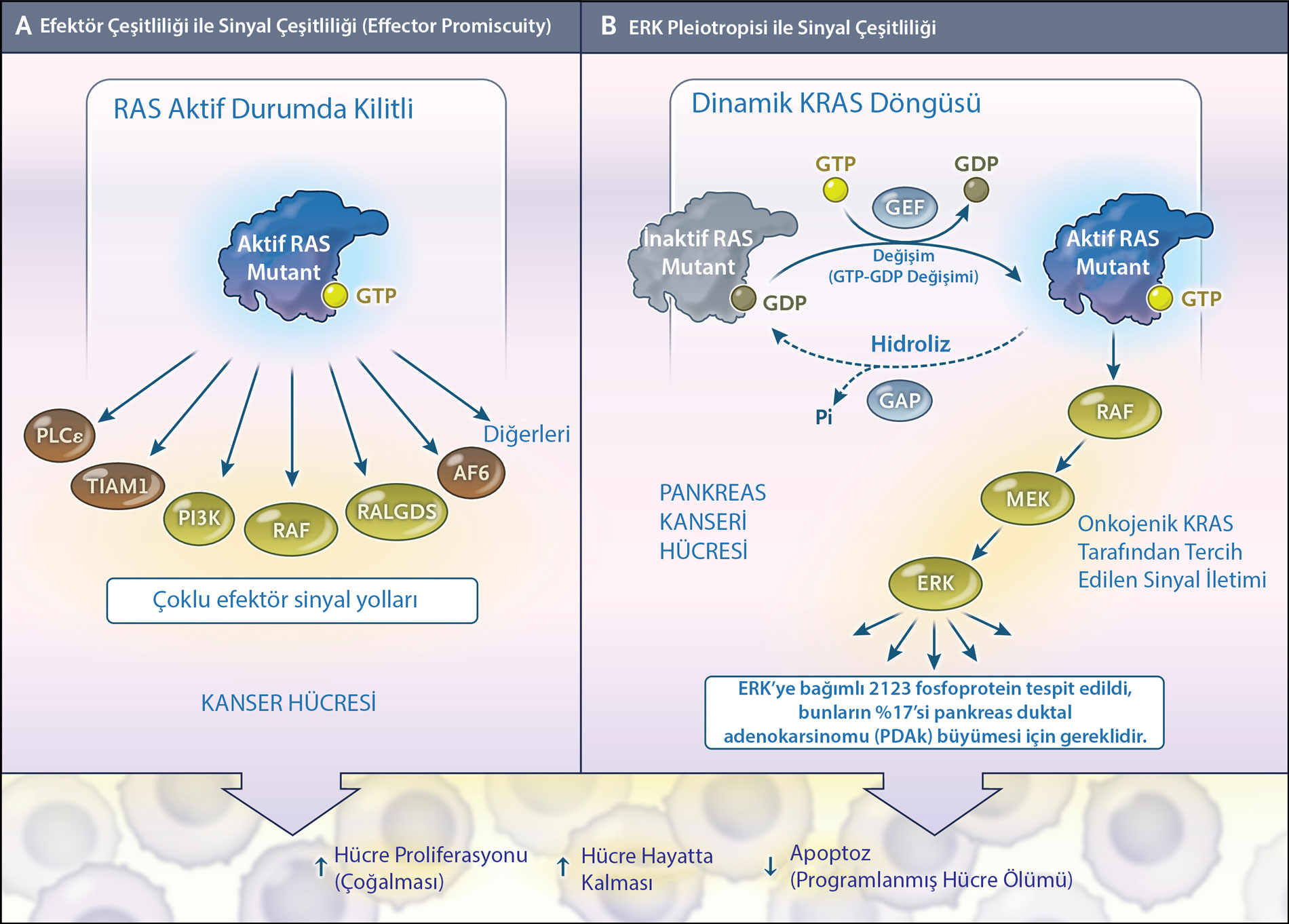
Figür Açıklaması:
Figür, KRAS onkoproteininin etkilerini iki farklı modelle açıklamaktadır:
- Panel A: Onkojenik RAS (KRAS, NRAS, HRAS) proteinlerinin birçok farklı efektör yolak üzerinden hücresel süreçleri düzenlediğini ifade eden geleneksel model.
- Panel B: Yeni KRAS inhibitörleri ışığında geliştirilen rafine model. Bu modele göre mutant KRAS, GTP bağlı aktif ve GDP bağlı inaktif durumlar arasında döngü yapmaktadır. Bu döngü, inhibitörlerin KRAS’ın "kapalı" konumda olduğu süreçte devreye girmesi için fırsat penceresi sunmaktadır.
ERK’nin Çok Yönlü Etkileri
Jennifer Klomp ve ekibi, kütle spektrometrisi kullanarak ERK sinyalinin protein fosforilasyonundaki etkilerini analiz etti ve 2123 ERK’ye bağlı fosfoprotein tespit etti. Bu proteinlerin üçte ikisi daha önce rapor edilmemişti.
ERK’nin, hücre döngüsünün tüm aşamalarında, DNA replikasyonu, RNA işlenmesi, hücreler arası iletişim ve hücre ölümüne kadar geniş bir yelpazede süreci etkilediği anlaşıldı. Çalışmanın bulguları şöyle özetlenebilir:
- ERK fosfoproteinlerinin %17’si hücresel çoğalma için kritik bulundu.
- Bu durum, KRAS mutasyonuna bağlı pankreas kanserlerinin büyük ölçüde ERK sinyali ile hayatta kaldığını gösteriyor.
Direnç Mekanizmaları ve Alternatif Yollar
KRAS-RAF-MEK-ERK yolunu hedefleyen tedavilerde tümörler, bazı durumlarda direnç geliştirebiliyor. Çalışmalar, KRAS inhibitörlerine karşı geliştirilen potansiyel adaptasyon mekanizmalarını da ortaya çıkardı:
- RHO proteinleri gibi RAS ailesine ait diğer üyeler sinyal yolunu devralabiliyor.
- ERK ile aynı hedef proteinleri etkileyebilen farklı kinazlar aktive olabiliyor.
Bu nedenle, bu bulguların klinik olarak doğrulanması önemlidir. Özellikle KRAS inhibitörleri ile tedavi edilen hastalardan alınacak doku örnekleri, bu adaptasyon mekanizmalarının daha iyi anlaşılmasını sağlayabilir.
KRAS İnhibitörleri ve Klinik Başarı
Doğrudan KRAS’ı hedefleyen küçük moleküllü ilaçların klinik deney sonuçları, şimdilik sınırlı fayda sağlamıştır. Bu durumun altında yatan iki temel mekanizma olabilir:
- Effektör çeşitliliği: KRAS’ın birden fazla sinyal yolunu eş zamanlı olarak aktive etmesi.
- Tek yolak üzerinde çoklu etki: KRAS’ın esas olarak ERK üzerinden birçok farklı hücresel süreci düzenlemesi.
Klomp ve ekibinin çalışmaları, ERK sinyal yolunun farklı düğümlerinin eş zamanlı hedeflenmesi gerektiğini ortaya koyuyor. Ancak diğer paralel yollar da tümör büyümesine katkıda bulunuyorsa veya direnç mekanizmaları olarak devreye giriyorsa, bu yolların da hedeflenmesi gerekebilir.
Sonuç: Daha Etkili Tedaviler İçin Çok Yönlü Yaklaşım
Her yıl yaklaşık 3,4 milyon hastaya RAS mutasyonuna sahip kanser tanısı konuluyor. KRAS-mutant kanserlerin tedavisini geliştirmek için farklı sinyal yollarını eş zamanlı hedef alan yeni tedavi stratejileri geliştirilmelidir. Bu doğrultuda, özellikle PI3K ve RAS etkileşimini kesebilen yeni ilaçlar, tedavi başarısının artırılmasında önemli bir rol oynayabilir.
BBO-10203 gibi yeni klinik denemelerde yer alan moleküllerin sonuçları, KRAS sinyal yollarındaki açıkları kapatmak adına umut vadediyor. Sonuç olarak, kanserin biyolojik çeşitliliği ve sinyal mekanizmalarının anlaşılması, daha uzun süreli tedavi yanıtları ve daha iyi hasta sonuçları için kritik bir öneme sahiptir.
Lito P. KRAS Oncoprotein Signaling in Cancer. N Engl J Med. 2025 Jan 16;392(3):296-298. doi: 10.1056/NEJMcibr2408099. PMID: 39813652.