Kış uykusuna yatan kanser hücreleri
Kanser hücreleri evrimsel hayatta kalma mekanizmasından faydalanarak, kemoterapi ve diğer hedeflenmiş ajanlar tarafından yaratılan zor bir çevrede yaşayabilmek için durgun ve yavaş bölünme durumuna geçerler.
7 Ocak 2021’de Cell dergisinde yayımlanan bir makalede, Prenses Margaret Kanser Merkezi bilim insanlarından Dr. Catherine O’Brien ve ekibi, sadece bir alt kümenin değil tüm kanser hücrelerinin tehdit altında olduğunda veya kemoterapiye maruz kaldığında, bu durum geçene kadar hücrelerin dinledikleri korumacı bir durumuna geçme yeteneğine sahip olduklarını keşfetti.
Uyuyan kanser hücrelerinin keşfi
Dr. O’Brien, üç yıl önce fare embriyolarında hayatta kalma stratejisini yönlendiren hücresel mekanizmalar üzerine bir konuşmayı dinlediğinde, bu konuşmanın onun için bazı şeyler için fikir oluşturduğunu söylüyor. "Kanser hücreleri de kemoterapiye karşı bu hayatta kalma mekanizmasıyla kaçıyor olabilirler mi?"
Bunu üzerine Dr. O’Brien, konuşmayı yapan Toronto Mt. Sinai Hastanesi araştırmacısı Dr. Ramalho-Santos ile iletişim kurdu. Kemoterapi kaynaklı yavaş bölünme durumdaki kanser hücrelerinin gen ifade profilleri ile Dr. Ramalho-Santos’un laboratuvarındaki duraklatılmış fare embriyolarını karşılaştırdı ve dikkat çekici derecede benzerliklerini buldu.
Bu kanser hücrelerinin kemoterapide hayatta kalmak için evrimsel bir korunma programına kaçtığını tanımlayan ilk çalışmadır. Dahası, araştırmacılar yeni tedavi stratejileri ile bu yavaş bölüme durumundaki kanser hücrelerini hedeflemeyi amaçlayan uygulamalarının, kanserin tekrar büyümesini engelleyebileceğini gösterdi.
Tümör, hayatta kalmak için enerji tasarrufu yapıyor
Aynı zaman Toronto Üniversitesi Cerrahi Bölümünde yardımcı Profesör olan Dr. O’Brien “Bütün bir organizma gibi hareket eden tümör, enerjisini koruyarak hayatta kalmasına yardımcı olacak yavaş bölünme durumuna girebilir… Zorlu çevresel koşullara karşı koymak adına tersine de dönebilen bir yavaş bölünme durumuna giren hayvan deneyleri vardır… Öyle görünüyor ki kanser hücreleri hayatta kalma menfaatleri için bu aynı durumu sinsice birlikte seçmişler.”
Prenses Margaret Kanser Merkezinde kıdemli bilim insanı ve Araştırma Enstitüsünün yöneticisi Dr. Aaron Schimmmer bu araştırmanın kanser hücrelerinin “kışın uyuyan ayılar” gibi kış uykusuna yattıklarını gösterdiğini söylüyor ve devam ediyor: “Biz aslında kanser hücrelerinin ayılar gibi kış uykusuna yattıklarını hiç bilmiyorduk. Bu çalışma ayrıca bize bu uyuyan ayıları nasıl hedef alacağımızı da söylüyor böylelikle daha sonra kış uykusuna yatmazlar ve beklenmedik bir şekilde tekrar gelmek için uyanmazlar… Bence bu, ilaca direncinin önemli bir sebebini ortaya çıkaracak ve daha önce iyi bir şekilde anlayamadığımız bazı şeyleri açıklayacaktır.”
Çalışmanın detayları
Araştırmacılar insan kolorektal kanser hücrelerini kullandı ve laboratuvarda bir petri kabında bu hücrelere kemoterapi uyguladı. Bu, hayatta kalmak için az miktarda besine ihtiyaç duyarak, yayılmayı durduran tüm kanser hücrelerine karşı yavaş bir bölünmeye neden olur. Petri kabında kemoterapi kaldıkça, kanser hücreleri bu durumda kaldı. Bu düşük enerji durumuna geçmek için kanser hücreleri, yüksek veya düşük sıcaklık ya da besin eksikliği gibi ekstrem çevresel durumlarda embriyolarını vücutlarının içinde güvende tutmak için 100’den fazla memeli türü tarafından kullanılan embriyonik hayatta kalma programını birlikte seçmiştir.
Bu durumda, minimal hücre bölünmeleri vardır, oldukça azalmış metabolizma ve embriyo gelişimi beklemeye alınır. Çevre geliştiği zaman hamilelik üzerinde ters bir etki olmadan embriyo normal gelişimine devam edebilmektedir. Gastrointestinal (mide-bağırsak) kanserinde uzman bir cerrah olan Dr. O’Brien, sert kemoterapi çevresi tarafından saldırı altında olan kanser hücrelerinin embriyonik hayatta kalma stratejisine uyum sağlayabildiklerini açıkladı.
Dr. O’Brien “Kanser hücreleri, insanlar için kaybolmuş gözükse bile, bu evrimsel olarak korunmuş hayatta kalma stratejisine kaçabilmektedir” diyor. Kanser hücrelerinin tamamının hayatta kalmak için koordine bir davranış içinde bu duruma geçtiğini de ekliyor.
Otofajiyi engellemek tümörün korunma mekanizmasını dağıtıyor
Embriyolara benzer, yavaş bölünme durumdaki kanser hücreleri, kendini yiyen anlamına gelen otofaji olarak adlandırılan hücresel işlemin aktivasyonunu gerektirir. Bu, diğer besinlerin yokluğunda hayatta kalmak için diğer hücresel bileşenleri veya kendi proteinlerini “yediği” veya tahrip ettiği bir işlemdir.
Dr. O’Brien otofajiyi inhibe eden (baskılayan) küçük bir molekülü test etti ve kanser hücrelerinin hayatta kalmadığını buldu. Kemoterapi bu korumacı mekanizma olmadan kanser hücrelerini öldürdü.
“Bu, bize eşsiz bir tedavi fırsatı sunar. Onlar bu savunmasız yavaş döngü durumunda iken ilaç direnci yürüten genetik mutasyonu elde etmeden önce bizim bu kanser hücrelerini hedef almamız gerek… Bu, kemoterapiye karşı direnç ve nasıl üstesinden geleceğimiz hakkında düşünmek için yeni bir yoldur.”
Grafik özet
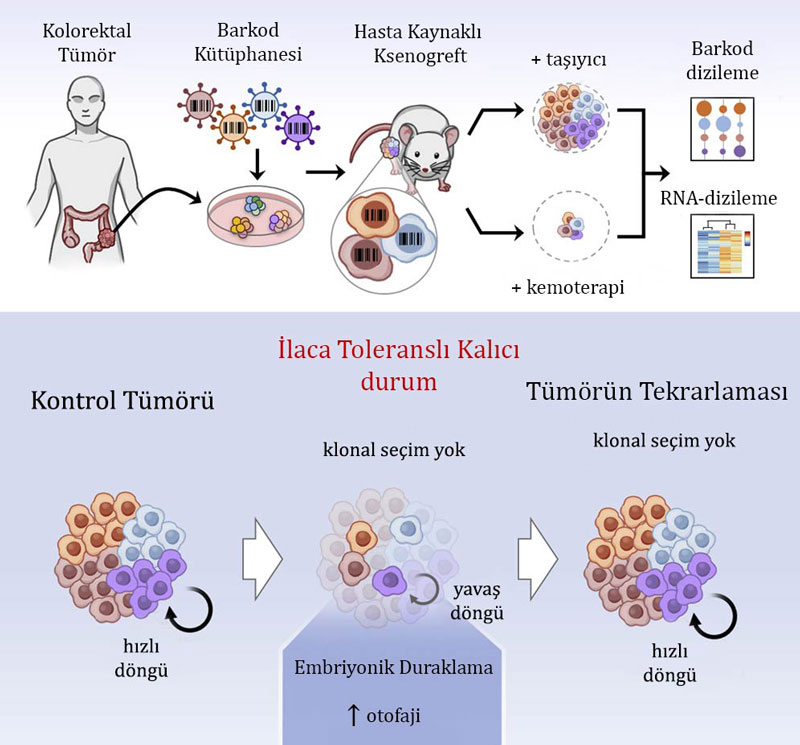
Kanser hücreleri hedeflenmiş ajanlardan ve kemoterapilerden dolayı gelecek ölümden kaçınmak için tersine çevrilebilir bir ilaç toleranslı dirençli (drug-tolerant persister= DTP) duruma geçerler. DTP’lerin tümörün nüksetmesi (tekrarlaması) ve tedavi başarısızlığının önemli yöneticileri olduğu giderek anlaşılmaktadır.
Kemoterapiye yanıt olarak DTP’leri tanımlamak ve karakterize etmek için hastadan elde edilen kolorektal kanser modellerinde hücresel barkodlama ve matematiksel modelleme birleştirildi.
Barkod analizi, DTP durumuna giren ve tedavinin kesilmesinden sonra tekrarlayan tümörlerin klonal karmaşasının hiçbir kaybı olmadığını ortaya çıkarır. Veriler, küçük bir alt grubun değil, tüm kanser hücrelerinin DTP durumuna geçmek için eş güçlü bir kapasiteye sahip olduğu bir matematiksel modele uyar.
Mekanik olarak, DTP’lerin elverişsiz çevre koşulları tarafından tetiklenen geçici olarak durdurulmuş embriyonik gelişimin tersine çevrilebilir bir durumu olan diyapoza (diapause) ile dikkat çekici transkripsiyonel ve işlevsel benzerlikler gösterdiği belirlenir.
Çalışma, kanser hücrelerinin DTP durumunu sürdürmek için gelişimsel olarak korunmuş bir mekanizmayı nasıl kullandıklarına dair fikir veriyor ve DTP’leri hedeflemek için yeni terapötik fırsatlara işaret ediyor.
1. Cancer cells hibernate like bears to evade harsh chemotherapy. (2021, Jan 07). University Health Network: www.uhn.ca adresinden alındı
2. Colorectal Cancer Cells Enter a Diapause-like DTP State to Survive Chemotherapy. (2021, Jan 07). Cell: www.cell.com adresinden alındı