KRAS G12C Mutasyonu Pozitif Akciğer Kanseri için Adagrasib FDA Onayı Aldı
Tümörleri KRAS G12C adı verilen özel bir genetik mutasyona sahip olan ve önceden en az bir sistemik tedavi almış olan küçük hücreli dışı akciğer kanseri (KHDAK) olan yetişkin hastalar için adagrasib (Krazati, Mirati Therapeutics, Inc.) adlı akıllı ilaca, 12 Aralık 2022'de FDA (ABD Gıda ve İlaç İdaresi) hızlandırılmış onay verdi. Bu, küçük hücreli olmayan akciğer kanserlerindeki mutasyonların yaklaşık %25'ini oluşturan herhangi bir KRAS mutasyonuna sahip tümörler için onaylanmış ikinci hedefli tedavidir. KRAS G12C mutasyonları, küçük hücreli dışı akciğer kanserlerindeki mutasyonların yaklaşık %13'ünü temsil eder.
KRAS Nedir?
KRAS'ın insan kanserinde en yüksek oranda mutasyona uğramış onkogenlerden biri olduğu bilinmektedir. KRAS'taki mutasyonlar, RAS/MAPK sinyal kaskadı yoluyla birden fazla kanser türünün büyümesini ve çoğalmasını sağlar.

En yaygın KRAS G12 mutasyonları G12D (%36), G12C (%14) ve G12V'dir (%23).
KRAS mutasyonları bir zamanlar hedeflenemez ve tedavi edilemez olarak kabul ediliyordu, ancak sotorasib etken maddeli Lumakras adlı ilacın, KRAS G12C mutasyonuna uğramış küçük hücreli dışı akciğer kanserlerine karşı etkili olduğu kanıtlandı ve FDA (ABD Gıda ve İlaç İdaresi) onayı aldı. Böylelikle Mayıs 2021'de sotorasib, ABD’de kullanım için onaylanan ilk KRAS hedefli kanser tedavisi oldu.
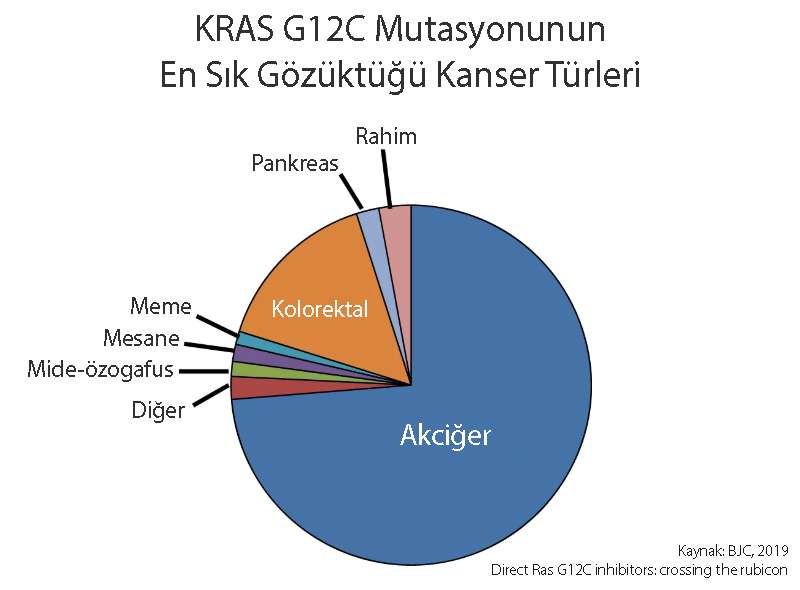
Aşağıda, KRAS G12C mutasyonunun en sık gözüktüğü kanser türleri görülebilir:
Adagrasib Nedir?
Adagrasib KRAS G12C'yi seçici ve geri dönüşümsüz olarak baskılayan, kanserli hücreleri guanozin difosfata kilitleyerek hücrelerin büyüme-çoğalmasını engelleyen bir RAS GTPaz baskılayıcı ajandır.
24 saatlik bir yarılanma ömrü, geniş doku dağılımı ve doza bağımlı farmakokinetiği ile günde iki kez 600 mg'lık bir dozda ağızdan hap şeklinde adagrasib uygulama, kanser hücrelerinde KRAS gen aktivitesini baskılar.
FDA bu onayla birlikte ayrıca QIAGEN therascreen KRAS RGQ PCR kitini (doku) ve Agilent Resolution ctDx FIRST Assay'i (kandan) Krazati için eşlik eden teşhis araçları olarak onayladı. Kandan bakılan likit biyopside mutasyon saptanmazsa, tümör dokusu test edilmelidir.
KRYSTAL-1 Çalışması ile Gelen FDA Onayı
Onay, KRAS G12C mutasyonları olan bölgesel olarak ilerlemiş veya metastatik KHDAK'li hastaları içeren çok merkezli, tek kollu, açık etiketli bir klinik çalışma olan KRYSTAL-1'e dayanıyordu. Etkinlik, aynı anda veya ardışık olarak verilen platin bazlı kemoterapi ve bir immün kontrol noktası inhibitörü sırasında veya sonrasında hastalığı ilerleyen 112 hastada değerlendirildi. Hastalar, hastalık ilerlemesine veya kabul edilemez yan etkiye kadar günde iki kez oral olarak 600 mg adagrasib aldı.
Ana etkililik sonuç ölçütleri, kör bağımsız merkezi inceleme tarafından değerlendirildiği üzere, doğrulanmış objektif yanıt oranı ve yanıt süresidir.
- Objektif yanıt oranı %43 (%95 GA: %34, %53) ve
- Ortanca yanıt süresi 8,5 aydı (%95 GA: 6,2, 13,8).
En yaygın (≥ %20) yan etkiler ishal, bulantı, yorgunluk, kusma, kas-iskelet ağrısı, karaciğer hasarı, böbrek yetmezliği, nefes darlığı, ödem (şişlik), iştah azalması, öksürük, pnömoni (zatürre), baş dönmesi, kabızlık, karın ağrısı ve EKG'de QTc aralığının uzamasıdır. En yaygın (≥ %25) laboratuvar anormallikleri azalmış lenfositler, artmış aspartat aminotransferaz (AST), azalmış sodyum, azalmış hemoglobin, artmış kreatinin, azalmış albumin, artmış alanin aminotransferaz (ALT), artmış lipaz, azalmış trombositler, azalmış magnezyum ve azalmış potasyum idi.
Önerilen adagrasib tablet dozu, hastalık ilerlemesine veya kabul edilemez yan etkiye kadar günde iki kez 600 mg'dır.
FDA grants accelerated approval to adagrasib for KRAS G12C-mutated NSCLC