
Safra Yolu Kanserinde İmmünoterapi Durvalumab FDA Onayı Aldı
Bölgesel olarak ilerlemiş veya metastatik (4. evre) safra yolu kanserli hastalar için durvalumab (Imfinzi, AstraZeneca) isimli immünoterapinin, gemsitabin artı sisplatin kemoterapi rejimine eklenmesi, 2 Eylül 2022'de FDA (ABD Gıda ve İlaç Dairesi) tarafından onaylandı.
Safra Yolu Kanseri Tedavisi için İlk İmmünoterapi Onayı
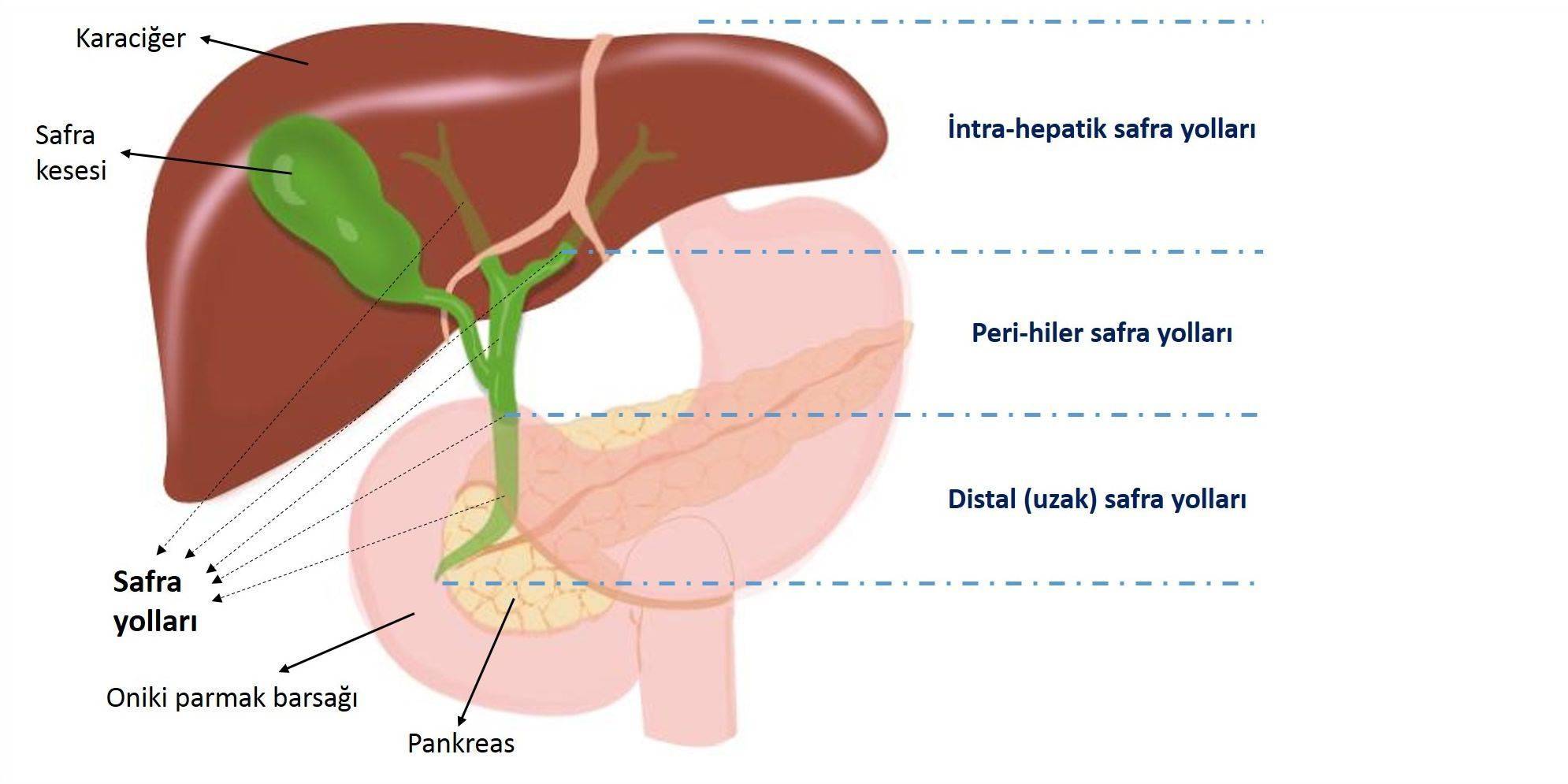
Safra yolu kanseri, safra kanalları ve safra kesesinden kaynaklanan, nadir görülen ve sıklıkla agresif bir hastalıktır; ABD'de her yıl yaklaşık 12 bin kişide teşhis edilirken, Türkiye için bu rakamın 2 bin civarı olduğu hesaplanmaktadır. Safra kesesi dışında safra yolu kanserleri, intrahepatik (karaciğer içi), ekstrahepatik (karaciğer dışı) safra yolları olarak ikiye ayrılmaktadır. İmmünoterapinin bu hastalık grubunda kullanımından önce, erken evre intrahepatik safra kanalı kanserleri için 5 yıllık nisbi sağkalım oranı %25 ve erken evre ekstrahepatik safra kanalı kanserleri için sadece %15'tir. Safra yolu kanserlerine, kolanjiokanser de denilmektedir.
TOPAZ-1 Çalışması ile Gelen FDA Onayı
2022 başında dikkat çeken bir onkolojik gelişme olarak, ileri evre safra yolu kanserli hastalarda PD-L1 inhibitörü sınıfından bir immünoterapi olan durvalumabın gemsitabin ve sisplatin ikili kemoterapi rejimi ile kombinasyonunu araştıran randomize uluslararası faz III TOPAZ-1 çalışmasının sonuçları, durvalumab alan hastalarda yaşam kaybı riskinin %20 daha düşük olduğunu gösterdi.
Sisplatin + gemsitabin + durvalumab alan hastaların, sisplatin + gemsitabin + plasebo alanlara karşı progresyonsuz (ilerlemesiz) sağkalımı da önemli ölçüde daha iyi idi. Çalışmanın bulguları, durvalumab artı gemsitabin ve sisplatinin, hastalık için yeni bir birinci basamak tedavi standardı haline getirdi. Dr. Do-Youn Oh ve arkadaşlarının çalışması, 2022 ASCO Gastrointestinal Kanserler Sempozyumu'nda sunulmuştu.
Bu çift kör çalışmada, bölgesel olarak ilerlediği için ameliyatla çıkarılamayan, tekrarlamış veya metastatik safra yolu kanserine sahip olup daha önce tedavi tedavi görmemiş hastalar rastgele 1:1 oranında durvalumab veya plasebo koluna atandı ve ardından hastalık progresyonuna (ilerlemesine) veya kabul edilemez yan etkiye kadar durvalumab veya plasebo verildi.
Rastgele atama, kanser evresi, başlangıçta ameliyat edilememe, tekrarlama ve ana tümör bölgesi (intrahepatik kolanjiokarsinom, ekstrahepatik kolanjiokarsinom, safra kesesi kanseri) ile tabakalandırılmıştır. Çalışmanın birincil sonlanım noktası genel sağkalımdı; ikincil sonlanım noktaları, ilerlemesiz sağkalım, objektif yanıt oranı ve güvenliği içeriyordu.
Sonuçlar
Bu ara analiz için veri kesme tarihi itibarıyla (Ağustos 2021), 685 hastanın 341'i durvalumab artı gemsitabin/sisplatin ve 344'ü plasebo artı gemsitabin/sisplatin almak üzere atandı.
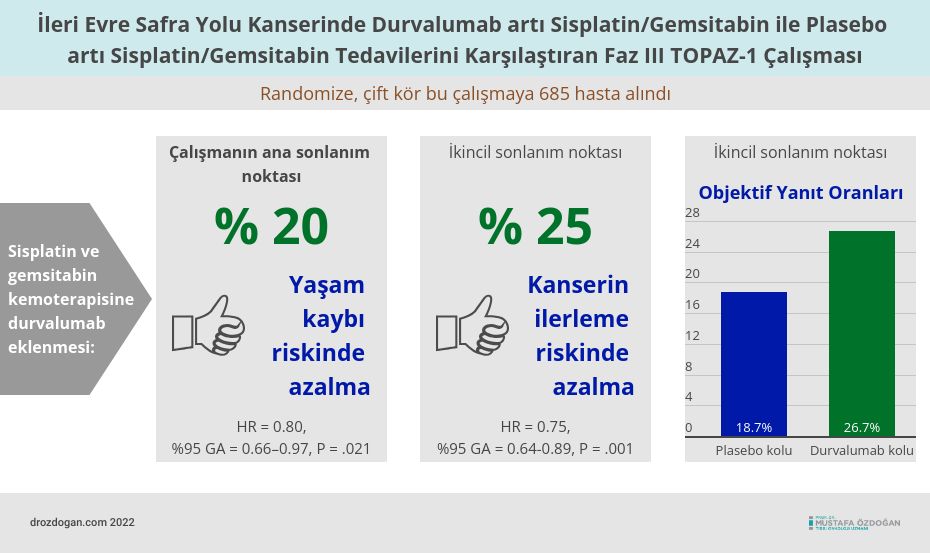
- Birincil hedefe ulaşıldı; durvalumab artı gemsitabin/sisplatin, plasebo artı gemsitabin/sisplatine kıyasla genel sağkalımı önemli ölçüde iyileştirdi: 12,8 aya karşı 11,5 ay (tehlike oranı [HR] = 0.80, %95 güven aralığı [GA] = 0.66–0.97, P = .021). Yaşam kaybı riskinde %20 azalma.
- Progresyonsuz sağkalım da plaseboya karşı durvalumab ile önemli ölçüde iyileştirildi: 7,2 aya karşı 5,7 ay (HR = 0.75, %95 GA = 0.64-0.89, P = .001). Kanserin ilerleme riskinde %25 azalma.
- Objektif yanıt oranı durvalumab ile %26.7 ve plasebo ile %18.7 idi.
- Durvalumab alan hastaların %62.7'sinde ve plasebo alan hastaların %64,9'unda tedaviye bağlı 3. veya 4. derece advers olaylar meydana geldi. Tedaviye bağlı advers olaylar, durvalumab alan hastaların %8,9'unda ve plasebo alan hastaların %11.4'ünde herhangi bir çalışma ilacının kesilmesine yol açtı.
Hastalarda meydana gelen en yaygın (≥%20) yan etkiler yorgunluk, bulantı, kabızlık, iştah azalması, karın ağrısı, döküntü ve ateştir.
Çalışmanın Önemi
Ameliyat edilemeyen veya 4. evre safra yolu kanserinde eski tedavi standardı, kombine kemoterapi idi ve bu standart on yıldan fazla bir süredir değişmemişti. TOPAZ-1 çalışması ile gelen FDA onayı, standart kemoterapiye immünoterapi eklenmesinin safra yolu kanserinde sağkalımı artırabileceğini ve daha da önemlisi, bunu herhangi bir yeni ciddi yan etki yaratmadan yaptığını gösteren ilk faz III klinik araştırmadır ve safra yolu kanserlerinde immünoterapi kullanımını yeni standart haline getirmiştir.
Önerilen durvalumab dozu, gemsitabin ve sisplatin ile birlikte verildiğinde vücut ağırlığı ≥30 kg olan hastalar için 3 haftada bir 1.500 mg, ardından hastalık ilerlemesine veya kabul edilemez yan etkiye kadar tek bir ajan olarak 4 haftada bir 1.500 mg'dır.
FDA approves durvalumab for locally advanced or metastatic biliary tract cancer. https://www.fda.gov 02.09.2022






