Uğur Şahin ve Özlem Türeci'nin Kanser Aşısı Çalışması
Kişiselleştirilmiş Kanser Aşısında Neoantijenler
Geliştirdikleri mRNA aşısı ile Covid-19 Pandemisi'nde dünya genelinde en çok konuşulan bilim insanları olan Uğur Şahin ve Özlem Türeci’nin liderliğindeki bir ekip, tedavi edici kanser aşısı adına önemli bir gelişmeye imza attı.
Bağışıklık sistemini kanser hücrelerine karşı aktifleştirmek için T hücrelerin neoantijenleri tanıma mekanizması, somatik mutasyonların tanımlanma ve neoantijen tahmini için hesaplamalı yaklaşımlar arasındaki bilimsel boşlukları dolduracak bu çalışma Nature'da yayımladı. Çalışmada, neoantijenlerin klinikte ne kadar yeterli antitümör bağışıklığı sağladıklarına bağlı olarak değerlendirildiği yeni bir sınıflandırma yer almaktadır.
Neoantijen Nedir?
Neo-, Yunanca neos yani "yeni" sözcüğünden türemiş ve eklendiği kelimeye en basit tabirle "yeni" anlamı katan veya "yeni" vurgusu yapan bir ön ektir. Antijen, vücuda girdiğinde antikor oluşmasına yol açan virüs, bakteri, parazit gibi protein yapısında bir madde. Neoantijen ise, kanser hücreleri tarafından üretilen ve vücut için yeni olan molekülleri ifade eder. Kanser hücrelerinde bulunan, fakat normal hücrelerde bulunmayan bu neoantijenler, yeni kanser tedavilerinin temel hedeflerinden biridir. Antikorlar ise, bağışıklık sistemi hücreleri tarafından üretilen, antijenlere bağlanan ve antijenlerin olumsuz etkilerini baskılayan protein yapıda moleküllerdir.
Neoepitoplar, insan bağışıklık sisteminin daha önce karşılaşmadığını antijenlerin antikora bağlandıkları bölgeleridir ve kanser hücrelerindeki somatik mutasyonlar sonucu, T hücrelerimiz tarafından tanınabilen bu neoantijenler üretilmektedir. Bu neoantijenler, sağlıklı dokularda ifade edilmediklerinden dolayı kanser aşıları için potansiyel tedavi hedefleridir.
Ayrıca mutasyonların çoğu da hastalara özgü olduğundan dolayı, bu potansiyel tedavi hedefleri, kişiselleştirilmiş tedavi yaklaşımları sunmaktadır.
Son zamanlarda adını çokça duyduğumuz makine öğrenim metotları kullanılarak kanser mutasyonlarının tanımlanması ve T hücreleri tarafından tanınma olasılığı yüksek olan neopitopları üretecek mutasyonların öncelikli olarak seçilmesi mümkün. Bu da kişiye özel olarak tasarlanmış aşıların üretilebilmesi, yani kişiselleştirilmiş kanser tedavisi anlamına gelmektedir.
Neoantijenlerin Sınıflandırılması
Kanser hücrelerinin normal hücrelerden farklı olmalarını sağlayan temel somatik mutasyonlar, tiplerine bağlı olarak farklı protein dizileri oluştururlar. Single Nucleotide Variants (Tek Nükleotidli Varyantlar) ya da SNV’ler, genom içindeki tek nükleotidin değişimidir ve çoğu kanserde en bol bulunan mutasyon tipidir. Çoğu SNV, tek bir aminoasidin yerine bir başka aminoasitin gelmesi ile neoantijen üretimine sebep olur. SNV’den elde edilmiş neoantijenler, melanom ve glioblastom gibi kanserlerde kişileştirilmiş neoantijen aşı çalışmalarında başarılı bir şekilde hedeflendirilmiştir.
Bununla birlikte, tekli nükleotidlerin (indels) eklenmesi veya silinmesi, gen füzyonu ve alternatif splicing de epitop oluşumuna neden olan mutasyonlardır. Ancak, füzyon (birleşme) şeklindeki genetik mutasyonlardan elde edilen neoantijenlerin immünoterapötik faydası henüz tam olarak anlaşılmamaktadır.
Tablo: Neoantijenlerin sınıflandırılmasında potansiyel fonksiyonel etkilerine bakılır.
|
NEOANTİJENLER |
FONKSİYONEL ETKİLERİ |
KLİNİK İLİŞKİSİ |
|
Koruyucu Neoantijenler |
Neoantijene özgü sitotoksik T hücrelerinin erken hazırlanması ve hızlı çoğalmasını sağlayan, güçlü antijenik etkiye sahip en önemli neoantijenler ve hazırlanmış bellek T hücreleri tarafından çapraz tanınan neoantijenler |
İmmünuterapi almamış bireylerde prognostik olarak ilişkili antitümör bağışıklık öncüsü |
|
Kısıtlı Neoantijenler |
İmmünoterapi almamış bireylerde immünojenik olan ve bağışıklık kontrol noktası blokajı (BKB) altında PD1+ bellek T hücrelerini tetikleyen neoantijenler |
İmmünterapi almamış bireylerde immünosupresyon nedeniyle aktif değildir. Klinik BKB’nin temel öncüsüdür |
|
Önemsiz neoantijenler |
Tümör olan bireyde bağışıklık yanıtını tetiklemeyen ancak bellek T hücreleri aşı ile tetiklendiğinde tümör bağışıklığını sürdürebilen neoantijenler |
İmmünoterapi almamış veya BKB ile tedavi edilmiş bireylerde tümör kontrolü üzerinde hiçbir etkisi yoktur. Neoantijen aşı üzerinde tümöre özgü T hücre çeşitliliğini artırarak poli-spesifik antitümör T hücre kontrolü sağlar |
Neoantijen Sunumu ve Tanınması
Ölmekte olan tümör hücreleri, neoantijen salgılar ve bu neoantijenler, ya hücre dışı sıvıda çözünebilir formda ya da antijen sunan hücreler (ASH'lar) tarafından tümör bölgesinden taşınarak lenf nodlarına ulaşabilirler. Lenf nodlarındaki hücreler tarafından neoantijenler, T hücrelerine sunulur ve böylelikle saf yeni nesil T hücreleri hazırlanarak aktive olurlar. Neoantijene özgü aktifleşmiş olan CD4+ ve CD8+ T hücreleri lenf nodlarını terk eder ve tümör hücrelerine girer. Burada da antitümör aktivite gösterirler.
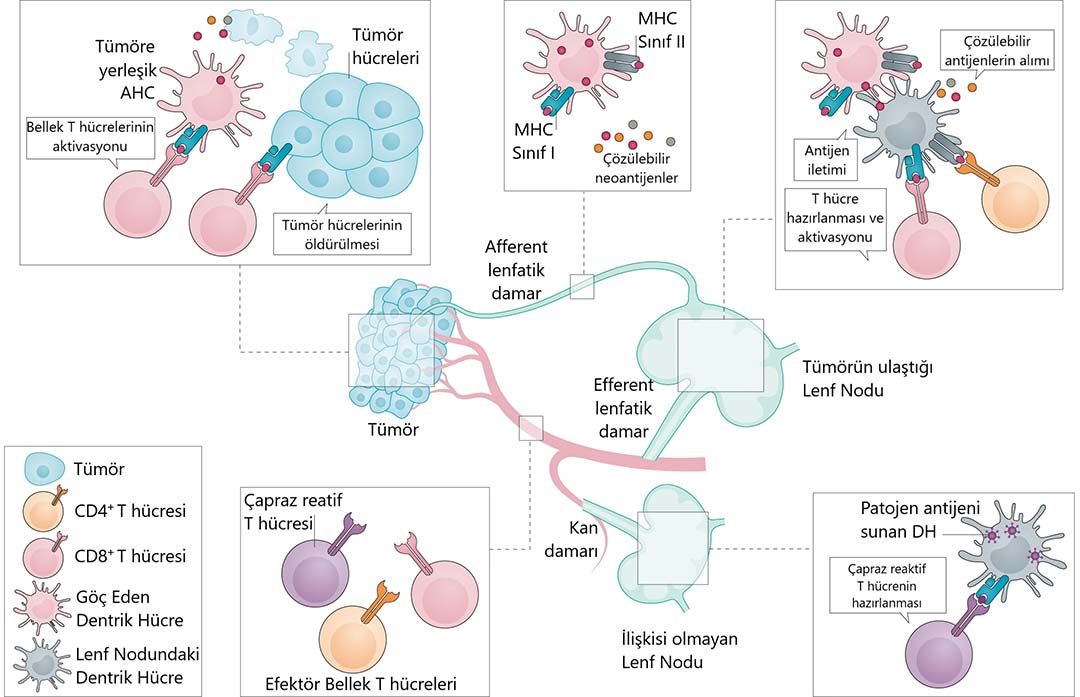
Şekil 1: Neoantijen aracılı tümör kontrol mekanizması
Neoantijen Tahmini ve Kişiselleştirilmiş Kanser Aşısı
Makine öğrenim teknikleri ile klinik yararı en yüksek olacak olan neoantijenlerin seçimi ve kişiselleştirilmiş kanser aşısı için ilk adım, hastanın kendi tümöründen ve sağlıklı dokusundan alınan örneklerin yeni nesil dizileme tekniği (NGS) kullanılarak karşılaştırılması ve protein kodlayan genlerdeki tümöre özgü mutasyonların tanımlanması ile başlar (Şekil 2.1 – 2.2).
Bu mutasyonların hepsi bağışıklık yanıtına yol açmaz ve neoepitopların hepsi, T hücre aracılı tümör öldürmede eşit derecede antitümör etki göstermezler. Bu nedenle, mutasyona uğramış bölgelerin özellikleri değerlendirilerek klinik olarak anlamlı ve antitümör T hücrelerini tetikleyebilecek adaylar seçilmelidir (Şekil 2.3).
Bu adımda önemli olan parametreler;
- Transkripsiyon seviyesi
- MHC bağlanması, stabilite ve hücre yüzeyine sunum
- Patojen ilişkili epitoplara benzerlik
- T hücre reseptörü tanıma
- Mutasyon klonalitesi
- Önemli gen ürünlerinin heterozigotluk kaybı
Süreç, mRNA veya uzun peptidler gibi bir aşı platformu ile kişiselleştirilmiş ve poli-spesifik neoantijen aşısının üretimi ile devam eder (Şekil 2.4). Uygulanan aşıdan, T hücre yanıtını indükleyerek, kanserin bağışıklık hücreleri tarafından tanınmasını sağlaması ve kanser-bağışıklık döngüsünün olması gerektiği formata getirmesi beklenir (Şekil 2.6 – 2.7).
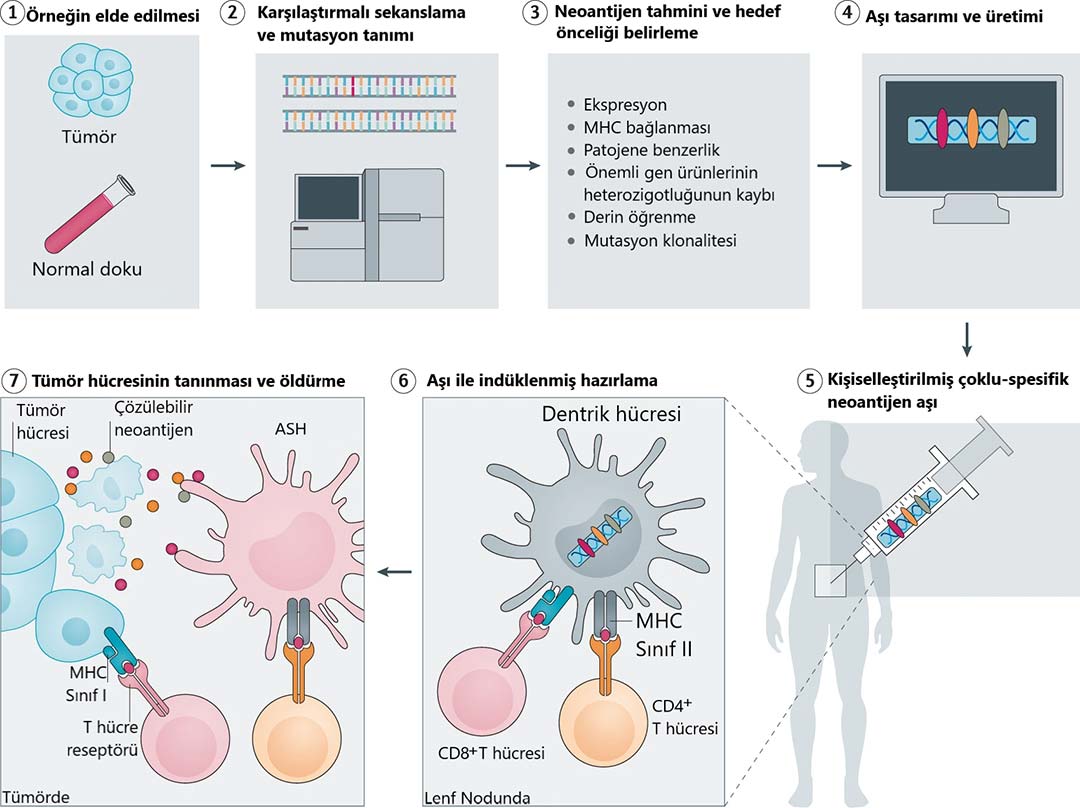
Şekil 2: Kişiselleştirilmiş neoantijen aşı mühendisiliği
Sonuç olarak, Uğur Şahin ve Özlem Türeci'nin öncülük ettiği bu çalışma, çok daha etkili ve hassas, tedavi edici kanser aşıları adına önemli bir adım olmuştur. Bu çalışma ile sunulan neoantijen sınıflandırması, neoantijen biyolojisi ile kanserin tıbbi ve klinik özelliklerini bağlamaya katkı sağlayacaktır. Ayrıca gelecekteki neoantijene dayalı tedavilerin daha fazla klinik fayda sağlamasına da olanak tanıyacaktır.
Lang, F., Schrörs, B., Löwer, M., Türeci, Ö., & Sahin, U. (2022). Identification of neoantigens for individualized therapeutic cancer vaccines. Nature Reviews Drug Discovery, 1-22.