Akciğer Kanserinde Optune Lua (Elektriksel Akım Tedavisi) FDA Onayı Aldı
15 Ekim 2024'te, Novocure firmasının geliştirdiği Optune Lua cihazı, immünoterapi veya dosetaksel ile eşzamanlı kullanım için FDA (ABD Gıda ve İlaç İdaresi) onayı adlı. Bu ikinci basamak tedavi onayı, platin bazlı tedavi sonrasında hastalığı ilerlemiş metastatik küçük hücreli dışı akciğer kanseri (KHDAK) olan yetişkin hastalar için geçerlidir ve önemli bir dönüm noktasıdır. Bu giyilebilir cihaz, kanser hücrelerinin bölünmesi sırasında elektriksel olarak yüklü bileşenlere fiziksel kuvvetler uygulayarak hücre ölümüne yol açan “tümör tedavi alanları” (TTF= tumor treating fields ) sağlar.
TTF Nedir? Etki Mekanizması Nasıldır?
Tumor-treating fields (TTF), tümöre düşük yoğunluklu alternatif elektrik akımı sunan bir anti-mitotik bölgesel kanser tedavi cihazıdır. Bu alternatif elektrik akımları, mitoz bölünmenin metafaz aşamasında iğsi cisimcikler oluşmasını ve dolayısı ile hücre bölünmesini baskılar. Bu da immünojenik hücre ölümüne ve artırılmış antitümör bağışıklık yanıtına yol açar. Bu tedavinin Novocure firması tarafından geliştirilen formu dünya genelinde ABD, Kanada, Japonya, Almanya, İsrail ve birçok Avrupa ülkesinde mevcuttur. Henüz ülkemizde bulunmamaktadır.

NOT: Novocure firmasının geliştirdiği Optune teknolojisi daha önce 2015'te glioblastoma multiforme (GBM) ve 2019'da mezotelyoma için FDA onayı almıştır.
LUNAR Çalışması ile Gelen FDA Onayı
Bu onay, sonuçları 2023'te Lancet Oncology dergisinde yayımlanan faz III LUNAR çalışmasından elde edilen verilerle desteklenmektedir. Bu randomize, açık etiketli, çok merkezli çalışma, tümör tedavi alanları tedavisinin immünoterapi (PD-1/PD-L1 inhibitörleri) veya dosetaksel ile eşzamanlı kullanımını (deneysel kol) sadece PD-1/PD-L1 inhibitörleri veya dosetaksel ile tedavi edilen kontrol grubuyla karşılaştırdı. Çalışma, platin bazlı tedavi sırasında veya sonrasında hastalığı ilerlemiş metastatik KHDAK hastalarını kapsamaktadır.
Yaşam Süresinde İyileşme: 3.3 Ay Önemli Bir Kazanım
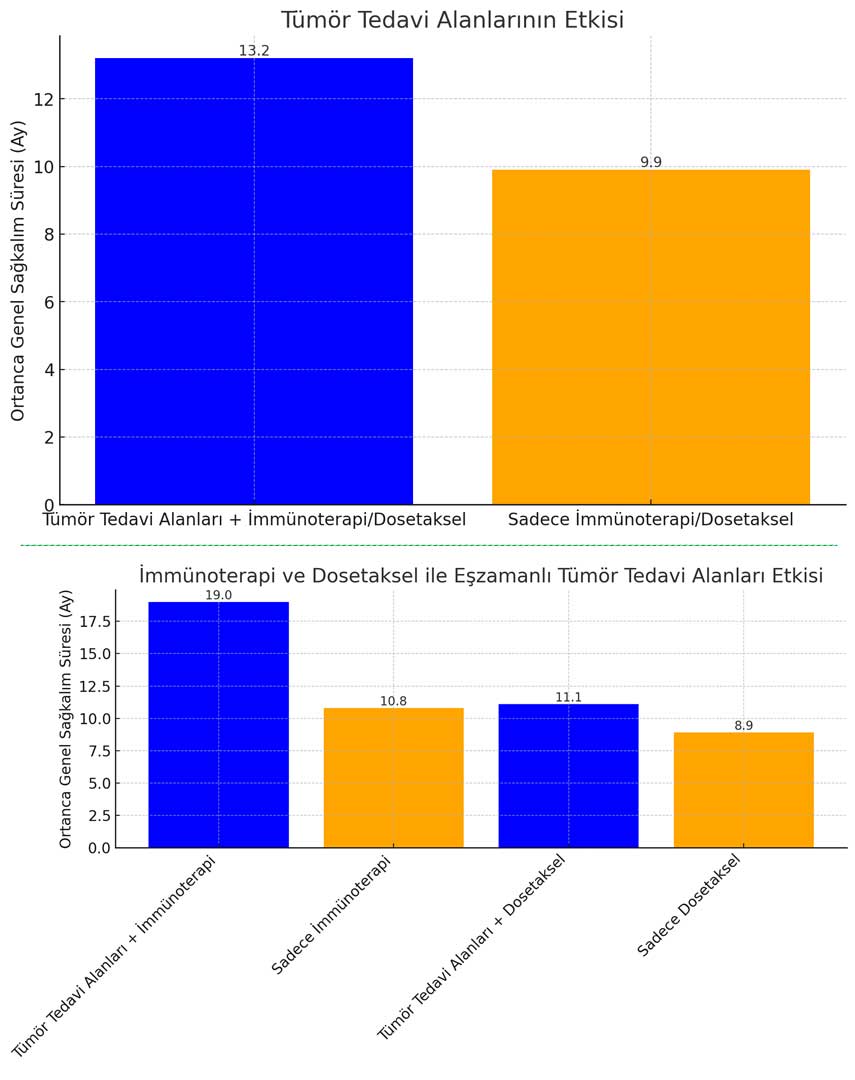
Çalışmanın birincil sonlanım noktası başarıyla elde edildi. Tümör tedavi alanlarının immünoterapi veya dosetaksel ile eşzamanlı kullanımının, yalnızca immünoterapi veya dosetaksel tedavisiyle kıyaslandığında, ortanca genel sağkalımda 3.3 aylık (P = .04) anlamlı bir artış sağladığı gösterildi. Tümör tedavi alanlarını alan grup için ortanca genel sağkalım süresi 13.2 ay (95% güven aralığı [GA] = 10.3–15.5 ay) iken, yalnızca immünoterapi veya dosetaksel tedavisi alan grupta bu süre 9.9 ay (95% GA = 8.2–12.2 ay) olarak saptandı.
İkincil Sonlanım Noktaları: PD-1/PD-L1 İnhibitörü ile Eşzamanlı Kullanımda 8 Ay Avantaj
LUNAR çalışması, önceden belirlenmiş iki ikincil sonlanım noktasını da içermekteydi. Birinci ikincil sonlanım noktası, tümör tedavi alanlarının immünoterapi ile eşzamanlı kullanımının, yalnızca immünoterapi tedavisine kıyasla sağkalım süresinde istatistiksel olarak anlamlı bir iyileşme sağladığını gösterdi. İkinci ikincil sonlanım noktası ise, tümör tedavi alanlarının dosetaksel ile eşzamanlı kullanımının, yalnızca dosetaksel tedavisiyle karşılaştırıldığında olumlu bir eğilim gösterdi ancak istatistiksel olarak anlamlı bir fark yaratmadı.
İmmünoterapi ile eşzamanlı olarak tümör tedavi alanları alan hastalar (70 hasta), ortanca 19 aylık (95% GA = 10.6–28.2 ay) bir genel sağkalım süresine ulaşırken, yalnızca immünoterapi alan hastalarda (71 hasta) bu süre 10.8 ay (95% GA = 8.3–17.6 ay) olarak belirlendi. Bu, sağkalım süresinde 8 aydan fazla bir fark yaratarak (P = .02) istatistiksel olarak anlamlı bulundu. Öte yandan, dosetaksel ile eşzamanlı tümör tedavi alanlarını alan hastalarda (75 hasta) ortanca genel sağkalım süresi 11.1 ay (95% GA = 8.2–13.9 ay) iken, sadece dosetaksel alan hastalarda (75 hasta) bu süre 8.9 ay (95% GA = 6.5–11.3 ay) olarak tespit edildi. Ancak bu 2.2 aylık iyileşme, istatistiksel olarak anlamlı bulunmasa da olumlu bir eğilim gösterdi.
Yan Etkiler ve Güvenlik Profili
Cihazla ilgili yan etkiler, özellikle cihazın uygulandığı bölgelerdeki cilt rahatsızlıkları şeklinde ortaya çıktı ve hastaların %63.1'inde (89 hasta) görüldü. Bu olayların çoğu 1. ve 2. derece yan etkilerdi, ancak %4’lük bir dilimde (6 hasta) tedaviye ara verilmesini gerektiren 3. derece cilt toksisitesi gözlendi. Tümör tedavi alanları tedavisi ile ilişkili 4. veya 5. derece toksisite veya tedaviye bağlı ölümler rapor edilmedi.
Hastaların Genel Durumu
Çalışmaya katılan hastaların başlangıçtaki özellikleri iki grup arasında dengeliydi. Katılımcıların ortanca yaşı 65’ti (aralık, 22–86 yıl); %66’sı erkekti ve hastaların %96’sı 0 veya 1 performans statüsüne sahipti (Eastern Cooperative Oncology Group [ECOG]). ABD’deki merkezlerde çalışmaya katılan hastaların %83’ünden PD-L1 ekspresyon verileri toplandı ve bu oran dört kohort arasında dengeliydi.
Bu onay, metastatik küçük hücreli dışı akciğer kanserinin tedavisinde önemli bir adım olarak değerlendirilmelidir ve özellikle hastalığı ilerleyen hastalar için yeni bir umut kaynağı sunmaktadır.
Leal T, Kotecha R, Ramlau R, Zhang L, Milanowski J, Cobo M, Roubec J, Petruzelka L, Havel L, Kalmadi S, Ward J, Andric Z, Berghmans T, Gerber DE, Kloecker G, Panikkar R, Aerts J, Delmonte A, Pless M, Greil R, Rolfo C, Akerley W, Eaton M, Iqbal M, Langer C; LUNAR Study Investigators. Tumor Treating Fields therapy with standard systemic therapy versus standard systemic therapy alone in metastatic non-small-cell lung cancer following progression on or after platinum-based therapy (LUNAR): a randomised, open-label, pivotal phase 3 study. Lancet Oncol. 2023 Sep;24(9):1002-1017. doi: 10.1016/S1470-2045(23)00344-3. PMID: 37657460.






