Bence-Jones Proteini Nedir? İsmi Nereden Gelmektedir?
Bence-Jones Proteini Nedir?
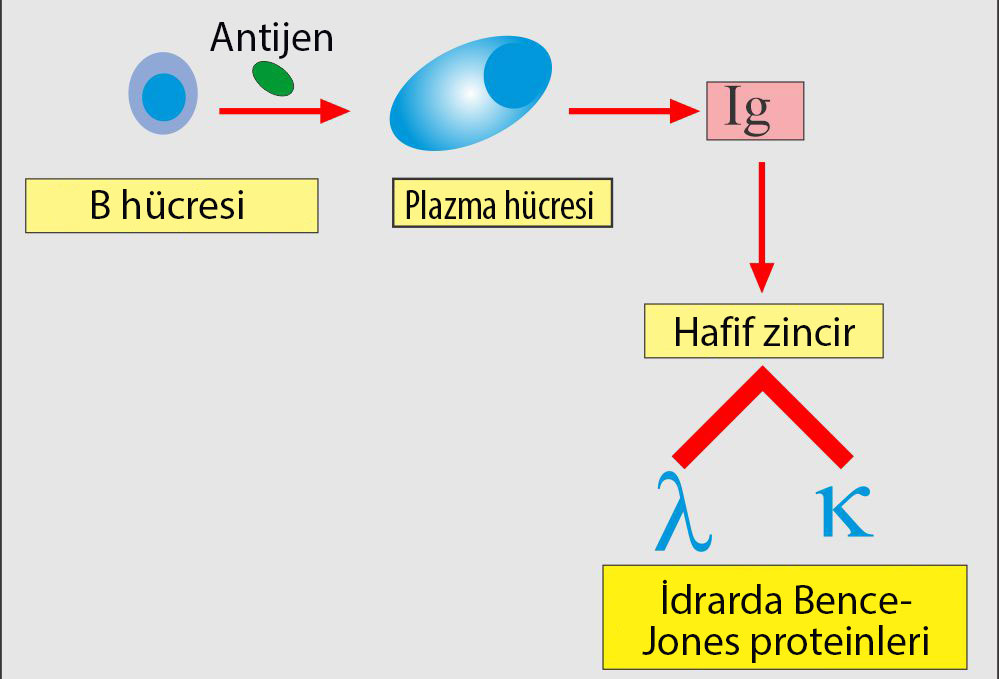
Bence-Jones proteini, antikor üreten beyaz kan hücreleri olan plazma hücreleri tarafından yapılan küçük bir proteindir. Plazma hücrelerinden başlayan bir hematolojik kanser olan multipl miyelomlu çoğu insanın idrarında bu protein bol miktarda bulunur.
Bir başka ifadeyle Bence-Jones proteinleri, immünoglobulinin monoklonal serbest hafif zincirleridir.
Bence-Jones protein seviyesinin artması genellikle kanser hastalığında görülür. İdrarda Bence-Jones proteinleri multipl miyelom tanısı dışında, Waldenstrom makroglobulinemisi, kronik lenfotik lösemi ve diğer B hücreli kanserleri olan hastalarda da gözlemlenir.
Bence-Jones Proteinin İsmi Nereden Gelmektedir?
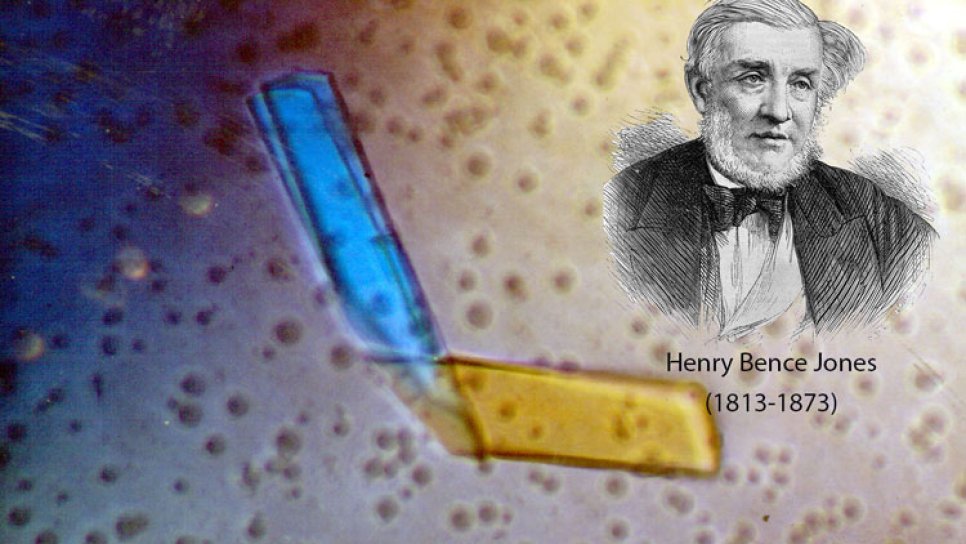
Bence-Jones proteinine ismini veren Henry Bence Jones, 1813 yılında İngiltere, Suffolk’de dünyaya geldi. Lisans, yüksek lisans ve tıbbi eğitimini Cambridge Üniversitesi'nde tamamladı.
1845 yılında Dr. Bence Jones, St. George Hastanesi'nde asistan doktor ve öğretim üyesi olarak görevlendirildi. Aynı yıl ani ve kalıcı göğüs ağrıları yaşayan Londralı bir bakkal olan Thomas Alexander McBean’den alınan idrar örneğini analiz etmesi istendi.
McBean’i tedavi eden Doktor William MacIntyre, durumu periferik ödem olarak not etmişti. Nefrotik sendromdan şüphelenen MacIntyre, hastanın idrarını ısıtıp soğutarak ve nitrik asit ekleyerek albümini çökeltmeye çalıştı. Örneği ısıtmak albüminin izole edilmesini sağladı ancak nitrik asit eklenmesi ile çökelti yok oldu. İdrar berraklaştı ve 1-1,5 saat böyle kaldı. Daha sonra örnek yeniden ısıtıldığında çözünen katı, sarı bir maddeye dönüştü.
Bu termolabilitenin sebebini tanımlayamayan Dr. MacIntyre, idrarın bir örneğini Dr. Bence Jones’e gönderdi. O da daha sonra kendi ismini vereceği bu ısıtılıp çökeltilmiş proteinin albüminden farklı bir protein olduğuna karar verdi.
McBean 1846 yılında yaşamını yitirdi ve otopsisinde yumuşak ve kırılgan kaburga kemikleri olduğu görüldü. Dr. Bence Jones’un daha sonra idrardaki bulgular üzerine yayımladığı 2 makalesinde okuyucularına, şu anda multipl miyelom olarak bilinen “mollities ossium” vakalarında bu proteini aramalarını önerdi.
“Bence-Jones protein” terimi ilk kez Dr. Richard Fleischer tarafından 1880 yılında kullanıldı. İdrardaki bulguları vurgulaması nedeniyle Dr. Bence Jones, proteinin keşfeden kişi olarak onurlandırıldı.
Dr. Bence Jones, 1873 yılında 60 yaşındayken kalp yetmezliğinde hayatını kaybetti. Onun yaşamını yitirdiği duyurulurken daha sonradan ismini alan idrardaki proteinler üzerine yaptığı çalışmalarından bahsedilmedi.
Dr. Bence Jones’den yıllar sonra, 1956 yılında Leonard Korngold ve Rose Lipari, mutipl miyelom hastaların serumunda bulunduktan sonra Bence-Jones proteinlerin monoklonal doğasını keşfetti.
*
Multiple Miyelom Tedavisinde Gelinen Son Nokta – Özet
Tanının doğrulanması: Multipl miyelomlu (MM) yeni bir hastayı değerlendirmenin ilk adımı, miyelomun premalign evreleri, yani önemi belirsiz monoklonal gammopati (MGUS) ve smoldering multipl miyelom (SMM) kolaylıkla MM olarak yanlış teşhis edilebildiğinden tanıyı doğrulamaktır.
- SMM'nin yönetimi, risk sınıflandırmasına bağlıdır.
- Altta yatan plazma hücre bozukluğuna veya diğer miyelom tanımlayıcı biyobelirteçlere atfedilebilen uç organ hasarı olan hastalar tedavi gerektirir.
- Doğrulanmış MM'si olan tüm hastalar derhal tedaviye başlamalıdır. Etkili tedavi olmadan semptomatik hastaların yaşam beklentisi bir yıldan azdır.
Risk sınıflandırması: Spesifik translokasyonlar ve belirli diğer testler için floresan in situ hibridizasyon (FISH) sonuçlarına dayalı olarak vakalar risk katmanlarına ayrılır. Bu risk sınıflandırmasının önemli bir prognostik değeri vardır ve ayrıca başlangıç tedavisinin seçimine rehberlik etmeye yardımcı olur.
- Yüksek riskli miyelom: t(4;14), t(14;16), t(14;20), del17p13 veya 1q eklendiği FISH ile gösterilen hastaları, laktat dehidrojenazı (LDH) üst sınırın ≥2 katı olanları ve birincil plazma hücreli lösemi özelliklerine sahip olanları içerir.
- Standart riskli miyelom: Yüksek riskli sitogenetik anormallikler veya özelliklerden herhangi biri olmayan hastaları içerir. Buna trizomi, t(11;14) ve t(6;14) hastaları dahildir.
Nakil uygunluğunun belirlenmesi: Tüm hastalar, nakil dışı stratejilerle karşılaştırıldığında hem olaysız hem de genel sağkalımı uzattığı görülen otolog hematopoietik hücre nakline (HCT) uygunluğu belirlemek için değerlendirilir. HCT için uygunluk kurumlar arasında farklılık gösterir. Kılavuzlar sağlanmış olmasına rağmen, uygunluk, risk-fayda değerlendirmesini ve hastanın ihtiyaç ve isteklerini dikkate almalıdır.
HCT için uygun hastalar, kemik iliği ve periferik kandaki tümör hücrelerinin sayısını azaltmak, semptomları azaltmak ve son organ hasarını azaltmak için kök hücre toplamadan üç ila dört ay önce indüksiyon tedavisi alırlar. Kök hücre koleksiyonundan iyileşmeyi takiben, hastalar doğrudan otolog HCT'ye geçebilir (erken transplant stratejisi) veya tedaviye devam edebilir, genellikle indüksiyon için kullanılan rejimle, otolog HCT'yi ilk relapsa kadar saklayarak (gecikmiş transplant stratejisi).
Standart riskli miyelomda tedaviye yaklaşım: Standart riskli MM tedavisi HCT uygunluğuna ve komorbiditelere bağlıdır.
- HCT için uygun olan standart riskli MM'li hastalar, kök hücre toplamadan önce üç ila dört ay boyunca üçlü rejimle tedavi edilir.
- Kök hücre toplanmasını takiben, tek başına kemoterapi veya allojenik HCT (Grade 1B) yerine erken veya gecikmiş otolog HCT'yi önerilir.
- Erken ve gecikmiş transplant stratejilerini değerlendiren çalışmalar, benzer sağkalım oranları göstermiştir, bu nedenle çoğu hasta için her iki seçenek de kabul edilebilir. Karar, hasta tercihi, yaş, ilk kemoterapiye yanıt ve tolere edilebilirlik ve lojistik faktörler dikkate alınarak kişiselleştirilir. Daha da önemlisi, nakli ertelemeyi seçen hastalarda, gelecekte onları nakil için uygun olmayan bir olay veya komplikasyon olabilir.
- Erken nakil ile devam edenlere nakil sonrası en az iki yıl idame tedavisi sunulur. HCT'yi ilk relapsa kadar ertelemeyi seçenler, toplam 8 ila 12 döngü üçlü tedaviyi ve ardından relapsa kadar lenalidomid bazlı idameyi tamamlar.
- HCT için uygun olmayan çoğu hasta için, 8 ila 12 döngü için bortezomib bazlı üçlü rejim ve ardından lenalidomid bazlı idame tedavisi önerilir. Kırılgan ve üçlü tedaviye aday olmadığı hissedilen hastalarda, 9 siklustan sonra tek ajan lenalidomide geçişle birlikte lenalidomid ve düşük doz deksametazon ile ikili tedavi önerilir.
Yüksek riskli miyelom: Yüksek riskli MM'li hastalar, tüm geleneksel tedavi seçenekleriyle başarısız olduklarından, yeni terapötik stratejileri araştıran bir klinik araştırmaya katılmaya teşvik edilmelidir. Klinik bir araştırmanın dışında, veriler sınırlıdır ve uzmanlar yaklaşımlarında farklılık gösterir. Nakil için uygun hastalar için, indüksiyon tedavisini takiben erken otolog HCT ve proteazom inhibitörü bazlı idame önerilir. Nakil için uygun olmayan hastalara 8 ila 12 döngü üçlü bazlı indüksiyon tedavisi ve ardından proteazom inhibitörü bazlı idame sunulur.
Tamamlayıcı tedavi: Malign klona yönelik tedaviye ek olarak, MM'li çoğu hastanın yönetimi, iskelet olayları, böbrek hasarı, enfeksiyonlar ve tromboz insidansını azaltmak için önleyici tedbirleri içerir. MM'li hastalar ayrıca hiperkalsemi, anemi ve nöropatinin yönetimi için özel müdahaleler gerektirebilir.
Yanıtın değerlendirilmesi: Hastalar, hastalıklarının tedaviye nasıl yanıt verdiğini belirlemek için her tedavi döngüsünden önce değerlendirilmelidir.
Nükseden hastalık: Nükseden veya refrakter MM genellikle rutin sürveyansta tanımlanır. Tedavi, önceki tedaviye, yanıta ve hastalığın önceki ajanlara duyarlı veya dirençli olma olasılığına göre bireyselleştirilir.
1. Alan P. Lyss, MD. Eponyms in Oncology: Bence-Jones Protein. Cancer Therapy Advisor. 20 May 2022
2. Chauveau D, Choukroun G. Bence Jones proteinuria and myeloma kidney. Nephrol Dial Transplant. 1996
3. Bence Jones protein. National Cancer Institute. Accessed May 19, 2022. cancer.gov
4. Rathore R, Coward RA, Woywodt A. What’s in a name? Bence Jones protein. Clin Kidney J. 2012
5. Stone MJ. Henry Bence Jones and his protein. J Med Biogr. 1998
6. Korngold L, Lipari R. Multiple-myeloma proteins. III. The antigenic relationship of Bence Jones proteins to normal gammaglobulin and multiple-myeloma serum proteins. Cancer. 1956






