Beyin Tümörü Yüksek Dereceli Glioma için Bağışıklık Tetikleyici Yeni Gen Tedavisi
Gelişen teknoloji ve elde edilen bilgiler sayesinde her geçen gün yeni ve etkili tedaviler geliştiriliyor. Eylül 2023'te Yoshie Umemura ve birçok bilim insanının ortak çalışmasıyla umut vadeden yeni bir tedavi yöntemi ortaya kondu. Bu çalışma, yetişkinlerde sıkça rastlanan ve olumsuz hastalık gidişatına sahip yüksek dereceli gliomaları hedef alıyor.
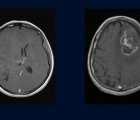
Yüksek dereceli glioma, beyin ve omurilik sinir sistemini oluşturan glial hücrelerden köken alan, hızlı büyüyen ve agresif bir beyin tümörü türüdür. Erişkinlerde en sık görülen primer malign (kötü huylu) beyin tümörüdür. Tedavisinde cerrahi, radyoterapi ve kemoterapi kullanılır. Yüksek dereceli gliomalar, genellikle "glioblastoma multiforme" (GBM) veya "anaplastik astrositoma" gibi isimlerle de anılır. "Yüksek derece" ifadesi, tümörün agresifliğini ve hızla büyüme potansiyelini belirtir. Yüksek dereceli gliomalar, Dünya Sağlık Örgütü'nün (DSÖ) beyin tümörleri sınıflandırmasında genellikle drade (derece) III ve grade IV olarak değerlendirilir. Bu kanser türü, tedavilere genellikle olumsuz yanıt vermesiyle biliniyor ve en önemli nedenlerden biri, kansere karşı etkili bir bağışıklık tepkisi oluşturabilmek için merkezi sinir sisteminde bulunması gereken fonksiyonel dendritik hücrelerin eksikliğidir. Yüksek dereceli gliomalarda ortanca sağ kalım süresi 14-16 aydır.
Virüs Aracılı Gen Tedavisi
Yüsek dereceli gliomalar için geliştirilen yeni gen tedavilerinde, insanlar için güvenli olduğu belirlenen viral vektörler (taşıyıcı virüsler) kullanılmıştır.
Kanser tedavisinde viral vektörler aracılığıyla, genetik olarak modifiye edilmiş virüsler vasıtasıyla, kanser hücrelerine yönelik özel olarak tasarlanmış genler, doğrudan tümör dokusuna iletilir. Bu yöntem, kanser hücrelerinin yok edilmesini sağlayan veya bağışıklık sisteminin tümör hücrelerine karşı daha etkili bir şekilde savaşmasına yardımcı olan genleri aktarır. Böylece, spesifik kanser hücrelerini hedef alırken sağlıklı hücrelere zarar verme riski minimize edilir ve tedavinin etkinliği artırılır.
Ancak, bu tedavilerde karşılaşılan zorluklar arasında, kanser hücrelerinin yerinde etkili bir şekilde öldürülememesi veya genetik materyalin yeterince yayılamaması bulunmaktadır. Bu durum, malign hücrelerin diğer bölgelere sızmasının önlenememesine yol açar.
Michigan Tıp Fakültesi'nde yürütülen bu klinik çalışma, Herpes Simplex Virus tip 1-timidin kinaz (HSV1-TK) ve FMS-gibi tirozin kinaz 3 ligandı (Flt3L) enzimlerinin kombinasyonunu içermektedir. HSV1-TK, prodrug valsikloviri fosforile ederek, yüksek dereceli gliomalarda olduğu gibi bölünen hücrelerde hücre ölümüne neden olan bir nükleozid analoğuna dönüştüren bir enzimdir. Flt3L, dendritik hücreleri tümör mikroçevresine çeker.
Flt3L ve HSV1-TK'nın birlikte kullanılması, dendritik hücrelerin tümör mikroçevresine girmesi ve endojen glioma antijenlerini artırması sonucunu doğurur. Bu antijenler, HSV1-TK tarafından tümör hücresinin sitotoksisitesine bağlı olarak salınır. Salınan antijenler, TLR2 agonisti olan HMGB1 enzimi ile birlikte aktifleşir ve dendritik hücreler, eksizyon ameliyatı sonrası kalan malign glioma hücrelerine karşı spesifik anti-glioma bağışıklık yanıtını indükler.
Bu yaklaşım, hayvanlar üzerinde yapılan pre-klinik çalışmalarda T hücrelerinin sitotoksik tepkisini, bağışıklık hafızasının kazanıldığını ve tümörün büyük bir kısmını yok ettiğini göstermiştir. Çift vektör kullanım tedavisinin güvenliği hayvanlar üzerinde gösterilmiş olsa da, insanlarda henüz kanıtlanmamıştır.
Eylül ayında yayımlanan çalışmanın hipotezi, HSV1-TK ve Flt3L'nin yeni tanı konmuş yüksek dereceli gliomalı hastalarda tümör çıkarıldıktan sonra CMV promotörü kontrolünde adenovirüs olarak birlikte uygulanabileceği ve ardından standart oral valasiklovir kemoradyoterapisi ile güvenli bir şekilde kombine edilebileceğidir. Bu kombinasyonun, anti-yüksek dereceli glioma karşıtı bir immün yanıtı oluşturacağı düşünülmektedir.
Çalışmanın ilk hedefi, Ad-hCMV-TK ve Ad-hCMV-Flt3L'nin maksimum tolere edilebilen dozunu bulmaktır. İkincil hedefler ise, genel sağ kalımı ölçerek ikili vektör tedavisinin potansiyel faydasını değerlendirmek ve ikinci bir ameliyattan alınan reseksiyon örneklerinde immün yanıtı bir belirteç olarak kullanarak inflamatuar yanıtların histopatolojik indekslerini araştırmaktır.
Çığır Açan Klinik Çalışmalar ve İlk Sonuçlar
Faz 1 çalışması olarak planlanan bu klinik deney, araştırmacının ve tedavinin uygulanacağı hastanın tüm prosedürleri bildiği açık bir şekilde yürütülmüştür. Deney, Michigan Tıp Fakültesi'nde, tamamı yetişkin olan ve yüksek dereceli gliomalara uygun olarak rezeksiyon sonrası supratentorial beyin lezyonu teşhisi konmuş 21 hastayla gerçekleştirilmiştir. Bu hastalara daha önce hiçbir gen terapisi, kemoterapi veya radyoterapi uygulanmamıştır. Hastalıklar, nöro-onkolojideki immünoterapi cevap değerlendirme sistemi ile değerlendirilmiştir. Bu sistem, yüksek dereceli gliomalar arasında grade 4 glioblastoma multiforme, grade 4 gliosarkomlar, grade 3 anaplastik astrositomalar, grade 3 anaplastik oligodendrogliomalar ve grade 3 anaplastik ependimomaları içermektedir. Hastaların durumları, Karnofsky Performance Status (KPS) ile değerlendirilmiştir. Bu değerlendirme, hastaların durumlarını 0 ile 100 arasında bir sayı ile ifade eder; 0, hastanın sağlıklı olduğunu, 100 ise hastanın öldüğünü gösterir. Deneydeki hastaların hepsinin KPS skorları 70 veya üzerindedir.
Deneyin viral vektörleri, Baylor College of Medicine'daki Hücre ve Gen Tedavisi Merkezi'nde üretilmiştir. Hastalara artan dozlarda 6 farklı vektör enjekte edilecektir. İlk 3 hastadan oluşan grubun dozları 1x10^10 Ad-hCMV-TK ve 1x10^9 Ad-hCMV-Flt3L olacaktır. Daha sonraki dozlar, gruplara göre artırılmıştır. Prosedür, eğer verilen dozda 3 hastada da doz sınırlayıcı toksisite görülmezse, dozun artırılmasını; eğer 3 hastadan 2'sinde bu toksisiteye rastlanırsa, denemenin durdurulup bir sonraki en düşük dozun tolere edilen maksimum doz olarak kabul edilmesini öngörür. HSV1-TK daha önce kullanıldığı için başlangıç dozu daha yüksektir. Buna karşın, Flt3L insanlarda ilk defa kullanılmaktadır. Dozlar belirlendikten sonra, 2 adet 1 mL tüberkülin enjektörü ile rezeksiyon sonrası oluşan boşluğa 20 farklı noktaya 0.1 mL olacak şekilde toplam 2 mL bu vektörler enjekte edilir. Vektör enjeksiyonundan sonra, 1-3. günlerde ve 10-12. haftalarda başlayacak şekilde iki kez 14 günlük valasiklovir tedavisine başlanır. Bu tedavide, hastalar günde 3 kez 2 gram dozunda valasiklovir alırlar. Farklı bir durum görülürse, valasiklovir dozunda modifikasyon uygulanabilir. Hastalar bu uygulamalardan 15-35 gün sonra standart kemoterapiye başlarlar. Çalışmanın olumsuz etkileri, Common Terminology Criteria for Adverse Events (CTCAE) versiyon 4 ile sınıflandırılmıştır. Eğer çift vektör enjeksiyonundan sonraki 21 gün içinde sınıflandırma içinde bulunan herhangi bir durum gözlemlenirse, bu durum yine doz sınırlayıcı faktör olarak değerlendirilir. Değişikliklerin olup olmadığını anlamak için, hastalardan ameliyattan önceki 14 gün içindeki geçmişleri, vital bulguları, kan sonuçları, radyolojik görüntüleri, fiziksel muayene sonuçları, KPS sonucu ve psikiyatrik muayene sonuçları kaydedilmiştir. Ayrıca, ameliyatta biyopsi ile tümörün türü onaylanır ve ameliyat sonrası MRG ile tümör rezeksiyonunun derecesi belirlenir. Önceden alınan sonuçlarla karşılaştırmak için, 2, 4, 6, 8, 10, 12, 14 ve 18. haftalarda testler tekrarlanır. Sağkalım takipleri ise 12. ve 24. ayda yapılarak klinik olarak sağ kalım takibi gerçekleştirilir. Eğer çalışma sırasında hasta tedaviyi reddederse, tedaviyi tamamlamazsa veya valasiklovirin 2. kürünü almazsa çalışmaya dahil edilmez. Ayrıca, hastanın katılım onayını geri çekmesi veya ölmesi durumunda, o hasta çalışmaya dahil edilmez.
8 Nisan 2014 ve 13 Mart 2019 arasında yapılan çalışmada başlangıçta 21 hasta çalışma için uygun görülmüştür. Daha sonra bir hasta hamilelik nedeniyle ve diğer bir hastada metastatik karsinoma görüldüğü için çalışmadan çıkarılmıştır. Çalışmanın ilerleyen aşamalarında bir hasta kendi isteğiyle çalışmadan çekilmiş ve bu nedenle çift vektör kullanım araştırması 8'i kadın, 10'u erkek olmak üzere toplam 18 hastayla tamamlanmıştır. Araştırma 2019 yılında bitirilmiş, ancak verilerin toplanması 14 Haziran 2021'e kadar devam etmiştir. 18 tümörden 17'si glioblastoma, bir tanesi ise anaplastik ependimomdur. Tüm tümörler, glioblastomayla ilgili olan genin agresif türüdür. Hastaların altısında tedaviden kaynaklandığı düşünülen bulantı, kafa karışıklığı, akut böbrek hastalıkları gibi yan etkiler görülmüştür. Ancak, bu etkilerden hiçbiri doz sınırlayıcı faktör olarak nitelendirilmemiştir. 10 hastada ise daha ciddi yan etkilere rastlanmıştır. Bu 10 hasta içindeki bir hastada pneumocystis pnömonisi (PCP, bir çeşit akciğer enfeksiyonu) görülmüştür ve maalesef o hasta hayatını kaybetmiştir. Bu ölüm, çalışmayla ilişkilendirilmemiştir. Başka bir hastada ise ameliyat ve çift vektör uygulanmasından sonra tümör yatağında kanama gözlemlenmiş ve gerekli tedaviler uygulandıktan sonra o hasta stabil bir şekilde taburcu edilmiştir. Kanamanın sebebi, çalışmayla ilişkilendirilmemiştir. Birçok yan etki gözlemlenmesine rağmen, doz sınırlayıcı faktörlere rastlanmamıştır. Ancak, Ad-hCMV-TK ve Ad-hCMV-Flt3L için maksimum doz belirlenememiştir. Hastalığın genel sağ kalım süresi 21,3 ay olarak hesaplanmıştır. Çalışmadaki 14 hasta, hastalığın ilerlemesi nedeniyle; 2 hasta, çalışmayla ilgili olmayan sebeplerden; 1 hasta ise nedeni belirlenemeyen bir sebepten ölmüştür. Bu kadar agresif ve ölümcül bir kanser türünde, ne yazık ki yüksek ölüm oranları görülmektedir. Ancak, çalışmada umut vadeden sonuçlar da alınmıştır. 12 aylık sağ kalım oranı %72,2 iken; 24 aylık sağ kalım oranı ise %38,8'dir. Asıl dikkat çekici olan ise, 18 hastadan 3'ünün 4 yıldır; bir hastanın ise tedavisinden sonra 59 aydır hayatta olmasıdır. Bu sonuçlar, glioblastoma için düşünüldüğünde, gelecek için pozitif bir bakış açısı sağlamaktadır. İmmünohistokimya ile incelenen 8 hastada, birincil ve tekrarlayan tümörler arasındaki farklar incelenmiştir. CD45+ hücrelerinde anlamlı bir farklılık gözükmemesine rağmen; CD3e+ hücrelerinde (T hücresi) ve CD8+ hücrelerinde anlamlı artışlar gözlemlenmiştir. Bu 8 hastanın 6'sında, tekrarlayan tümör mikroçevresindeki düzenleyici T hücrelerinde azalma görülmüştür. Bununla birlikte, tekrarlayan tümörlerde birçok T hücresi alt grubu ve makrofajlar arasında hücreden hücreye etkileşimin arttığı; tümör hücreleri ile makrofajlar arasındaki etkileşimlerin azaldığı gözlemlenmiştir. Bölgesel analizde ise, tekrarlayan tümörlerdeki bağışıklık başka bölgelerle karşılaştırıldığında, tümör bölgesindeki T hücreleri, çift pozitif T hücreleri ve plazmasitoid dendritik hücreler gibi bağışıklık hücrelerinin yoğunluğunun arttığı bulunmuştur. Ayrıca, 8 hastanın 5'inde yapılan analizlerden sonra, tekrarlayan tümörlerde artmış HSV1-TK hücrelerine rastlanmıştır. Bir hastada, enjeksiyondan 17 ay sonra bile çalışmanın etkileri gözlemlenebilmiştir. Flt3L'de ise, serum konsantrasyon analizi sonucuna göre, tedaviden 2 hafta sonraki değerinin başlangıç değerine göre önemli ölçüde arttığı görülmüştür.
Faz 1 Çalışmasının Önemi ve Geleceğe Dönük Beklentiler
Faz 1 çalışması olarak yapılan HSV1-TK ve Flt3L vektörlerinin kombinasyonunun tolere edilebilen ve maksimum dozuna henüz ulaşılamamıştır. Valasiklovir tedavisinden kaynaklandığı düşünülen yan etkiler gözlemlense de, valasiklovirin genel toksisiteye yararlı mı yoksa zararlı mı olduğuna araştırma boyutunun yetersizliği nedeniyle karar verilememiştir. Ayrıca, bazı sağ kalım oranlarına ulaşılsa da, bu çalışma sağ kalım analizi için yeterli değildir. Bunun için devam çalışmalarına ihtiyaç vardır. Devam çalışmalarında incelenebilecek diğer konular arasında, immün kontrol noktası blokajının eklenmesi ve tümör mikroçevresindeki bağışıklık baskılayıcıların azaltılması bulunmaktadır. Böylece, uygulanan tedaviden çok daha etkili sonuçlar alınabilir. Çalışmadan elde edilen bilgilere göre, viral vektör uygulamasından sonra kandaki antikor artışı, adenoviral vektörlerin rezeksiyon bölgesine enjekte edilmesinin sistemik humoral bağışıklık tepkisini başlatma veya güçlendirme potansiyeline sahip olduğunu göstermektedir. Yapılan incelemelerde, CD8+ T hücrelerinin ve plazmasitoid dendritik hücre sayılarının arttığı gözlemlenmiştir. Bu artışın, hastanın efektif bir anti-glioma immün cevabı vermesinde yararlı olduğu düşünülmektedir. Bu önemli varsayımın kanıtlanması için daha büyük faz 2 veya faz 3 deneylerine ihtiyaç duyulmaktadır. Bağışıklık hücrelerinin alt kümelerinin miktarları belirlenerek bazı hücre komşuluk analizleri yapılmıştır. Bunun sonucunda, alt küme oranlarının diğer çalışmalara göre farklı olduğu ve bağışıklık infiltrasyonunun tümör hücrelerinin yoğun olduğu bölgelerde, hem tümörün içinde hem de çevresinde meydana geldiği görülmüştür. Bu farklılığın sebebinin, viral vektör uygulamasından kaynaklandığı düşünülmektedir. Ayrıca, çalışma 2021 yılında açıklandığı gibi, bağışıklık sistemini baskılayan makrofajların artan CD8+ T hücrelerinin ve plazmasitoid dendritik hücrelerin etkisini azaltabileceğini göstermektedir. Ayrıca, transgen ekspresyonu ve immün infiltrasyonu için viral vektörlerin kullanımı, soğuk tümörleri (bağışıklık ve inflamasyon hücrelerinden yoksun olan tümörler) sıcak tümörlere (bu hücreler bakımından zenginleşmiş tümörler) çevirdiği düşünülmektedir. Bu çalışma, bu geçişin gerçekleştiğini de kanıtlamıştır.
Sonuç ve Gelecek Vizyonu
Sonuç olarak, bu araştırma, çifte vektör kullanımını ve dendritik hücrelerin tümör mikroçevresindeki yayılımını gösteren; valasiklovir uygulamasını araştıran çok önemli bir çalışmadır. Elde edilen bulgular, valasiklovirin uygulama alanının genişletilebileceğini ve adenoviral vektör aracılı transgen ekspresyonunun 17 ay kadar devam edebileceğini göstermiştir. Ve çalışmayla elde edilen umut verici hayatta kalma verileriyle bağışıklık hücrelerinin toplandığı yönündeki kanıtlarla, bu tedavinin gelecek için önemli bir potansiyele sahip olduğunu biliyoruz. Tedavinin etkisinin artması ve daha ayrıntılı kesin sonuçlara ulaşılabilmek için geniş ölçekli faz 2 ve faz 3 deneylerine ihtiyaç vardır.
Umemura Y, Orringer D, Junck L, Varela ML, West MEJ, Faisal SM, Comba A, Heth J, Sagher O, Leung D, Mammoser A, Hervey-Jumper S, Zamler D, Yadav VN, Dunn P, Al-Holou W, Hollon T, Kim MM, Wahl DR, Camelo-Piragua S, Lieberman AP, Venneti S, McKeever P, Lawrence T, Kurokawa R, Sagher K, Altshuler D, Zhao L, Muraszko K, Castro MG, Lowenstein PR. Combined cytotoxic and immune-stimulatory gene therapy for primary adult high-grade glioma: a phase 1, first-in-human trial. Lancet Oncol. 2023 Sep;24(9):1042-1052. doi: 10.1016/S1470-2045(23)00347-9. Erratum in: Lancet Oncol. 2023 Oct;24(10):e405. PMID: 37657463.