Binimetinib (Mektovi) Nedir? FDA Onayı, Türkiye Ruhsatı ve Geri Ödeme Durumu
- FDA Onaylı: Evet (İlk Onay Tarihi: 27 Haziran 2018)
- Kutu Adı: Mektovi
- Etken Madde Adı: Binimetinib
- Uygulama Şekli: Oral, tablet
- Sınıfı: Sinyal Transdüksiyon İnhibitörü, BRAF inhibitörü (daha spesifik olarak MEK inhibitörü)
- Kategori: Hedefe Yönelik Ajan
- Üretici: Array BioPharma
- Türkiye Dağılımı: Pierre Fabre İlaç A.Ş.
- Onaylı Olduğu Kanserler:
- Metastatik Melanom: Enkorafenib ile kombinasyon halinde, BRAF-V600E/K mutasyonu taşıyan rezeke edilemeyen veya metastatik melanom (2018).
- Metastatik Küçük Hücreli Dışı Akciğer Kanseri (KHDAK): Enkorafenib ile kombinasyon halinde, BRAF-V600E mutasyonu taşıyan metastatik KHDAK (2023).
Binimetinib Nedir?
Binimetinib etken maddeli Mektovi, hedefe yönelik bir kanser tedavi ilacıdır ve özellikle BRAF-V600E mutasyonu gibi belirli genetik değişikliklere sahip kanser hücrelerini hedef alır. Hücre büyümesini ve çoğalmasını destekleyen mitojenle aktive olan ekstraselüler sinyal düzenleyici kinaz 1 (MEK1) ve kinaz 2 (MEK2) üzerinde geri dönüşümlü bir inhibitördür.
NOT: Enkorafenib ve binimetinib, BRAF V600E mutasyon pozitif melanom başta olmak üzere bazı kanserlerin tedavisinde birlikte kullanılır çünkü bu kombinasyon, hem BRAF hem de MEK yolaklarını hedef alarak sinyal iletimini daha etkili bir şekilde baskılar. Bu sinerjik etki, kanser hücrelerinin direnç geliştirme riskini azaltır ve tedavi etkinliğini artırır.
Etki Mekanizması Nasıldır?
- Mitojenle aktive olan ekstraselüler sinyal düzenleyici kinaz 1 (MEK1) ve kinaz 2 (MEK2) üzerinde geri dönüşümlü bir inhibitördür.
- Ekstraselüler sinyal düzenleyici kinaz (ERK) yolunun aşağı yönlü düzenleyicilerinin inhibisyonu sonucu hücresel çoğalmayı baskılar.
- BRAF-V600 mutasyon pozitif melanomların (örneğin V600E) büyümesini inhibe eder.
- Binimetinib ve enkorafenib kombinasyonu, hem in vitro hem de in vivo BRAF mutasyon pozitif modellerinde (melanom ve kolorektal kanser gibi) büyüme inhibisyon etkilerini artırır.
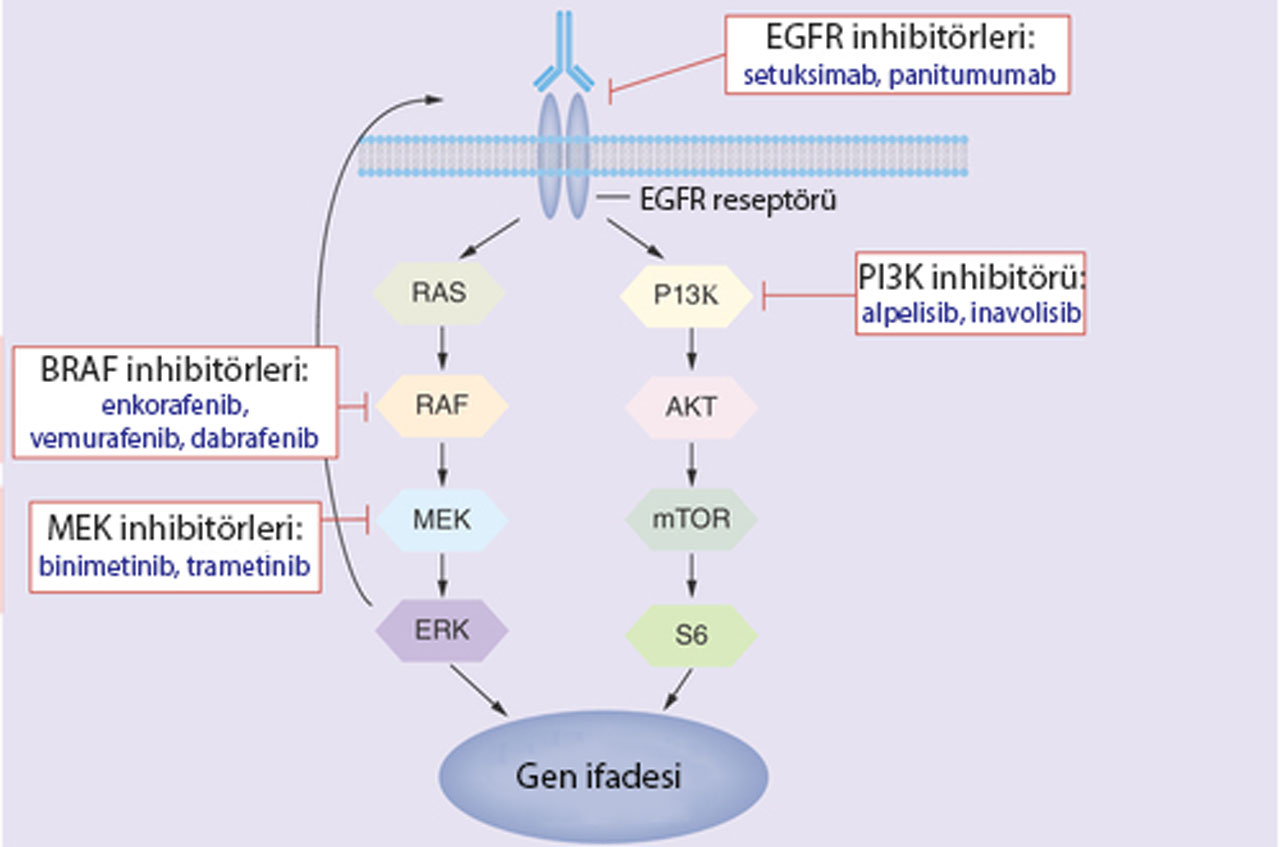
Yukarıdaki görsel, hücre içi sinyal yolaklarını ve çeşitli inhibitörlerin bu yolaklar üzerindeki etkilerini göstermektedir. EGFR reseptöründen başlayarak, hücre yüzeyinde sinyal alımı sonrasında RAS-RAF-MEK-ERK yolu ve PI3K-AKT-mTOR yolu gibi kritik hücresel sinyal iletim yolakları detaylandırılmıştır.
- BRAF inhibitörleri (enkorafenib, vemurafenib, dabrafenib) ve MEK inhibitörleri (binimetinib, trametinib) RAS-RAF-MEK-ERK yolunu hedef alarak hücre çoğalmasını durdurmayı amaçlar.
- EGFR inhibitörleri (setuksimab, panitumumab) ve PI3K inhibitörleri (alpelisib, inavolisib), sinyal iletiminde farklı noktaları inhibe eder.
Sonuç olarak bu yolakların çeşitli ilaçlarla baskılanması, gen ifadesi değişikliklerine yol açarak kanser hücresinin büyümesini ve çoğalmasını durdurmak için kullanılır.
FDA (ABD Gıda ve İlaç İdaresi) Onay Tarihçesi
- 11 Ekim 2023: FDA, Braftovi (enkorafenib) ile Mektovi (binimetinib) kombinasyonunu, BRAF V600E mutasyonu taşıyan metastatik küçük hücreli dışı akciğer kanseri (KHDAK) tedavisi için onayladı.
- 27 Haziran 2018: FDA, Braftovi (enkorafenib) ile Mektovi (binimetinib) kombinasyonunu, rezeke edilemeyen veya metastatik melanom hastalarında BRAF mutasyonları için onayladı.
Türkiye Ruhsatı
Binimetinibin ülkemizde T.C. ruhsatlı olduğu durumlar / terapötik endikasyonlar şu şekilde belirtilmiştir:
Terapötik Endikasyonlar:
Mektovi, daha önce herhangi bir RAF yolağı inhibitörü kullanmamış, ECOG performans skoru 0-1 olan ve lokal tedaviler sonrası progresyon gösteren, lokal tedavilerin tekrar uygulanamadığı lokal relaps veya metastatik BRAF V600E mutasyonu pozitif malign melanom hastalarında, encorafenib ile kombinasyon halinde progresyona kadar kullanımı için endikedir.
Mektovi Geri Ödemesi Var mı?
Ülkemizde Mektovi henüz geri ödeme kapsamına alınmamıştır. Ayrıca Sağlık Bakanlığı ruhsatı bulunmasına rağmen henüz ülkemizde satışa girmemiştir. Ancak, bu ilaç bir hastada kullanılması gereken bir tedavi seçeneği olduğunda, tıbbi onkoloji uzmanı tarafından yazılacak reçete ve raporla, hasta Türk Eczacılar Birliği’ne (TEB) başvurabilir. Bu başvuru sonucu, ilaç hasta için ithal edilebilir. TEB yurt dışı ilaç listesinde bulunmaktadır.
Fiyatı: Ülkemiz için MEKTOVI 15 mg 84 tablet satış fiyatı henüz belirlenmemiştir.
Direnç Mekanizması
- PI3K/AKT yolunun artmış ekspresyonu veya aktivasyonu.
- MAPK sinyal yolunun yeniden aktivasyonu.
- MEK2 mutasyonlarının gelişimi.
- NRAS mutasyonlarının varlığı.
- HER2-neu yolunun artmış ekspresyonu veya aktivasyonu.
Farmakokinetik Özellikler
Emilim
- Oral biyoyararlanımı yaklaşık %50’dir.
- İlacın maksimum plazma konsantrasyonuna oral alımdan 1,6 saat sonra ulaşılır.
- Yüksek yağ içeriği olan gıdalar, maksimum konsantrasyon (Cmax) ve eğri altındaki alan (AUC) değerlerini etkilemez.
Dağılım
- Plazma proteinlerine bağlanma oranı %97’dir.
Metabolizma
- Karaciğerde UGT1A1 glukuronidasyonu yoluyla metabolize edilir. Bunun yanı sıra, N-dealkilasyon, amid hidrolizi ve yan zincirden etanediol kaybı gibi diğer yollar da devreye girer.
- Aktif bir metabolit olan M3, karaciğerde CYP1A2 ve CYP2C19 aracılığıyla üretilir ve binimetinib maruziyetinin yaklaşık %9’unu oluşturur.
- İlaç büyük oranda hepatobiliyer yolla atılır (%62). Dozun yaklaşık %31’i böbrek yoluyla atılır.
Yarı Ömür
- Ortalama terminal yarı ömrü: 3,5 saat.
Dozaj
- Metastatik Melanom:
45 mg, günde iki kez (PO), enkorafenib ile kombinasyon halinde. - Metastatik Kolorektal Kanser:
45 mg, günde iki kez (PO), enkorafenib ve setüksimab ile kombinasyon halinde.
Dikkat Edilmesi Gereken Durumlar
-
Kalp Fonksiyonlarının Takibi (LVEF Değerlendirmesi)
- Tedavi öncesinde, tedavinin başlangıcından 1 ay sonra ve sonrasında her 3 ayda bir sol ventrikül ejeksiyon fraksiyonu (LVEF) değerlendirilmelidir.
- LVEF değerinde tedavi öncesi seviyeye göre %10'luk bir düşüş olması durumunda, tedaviye ara verilmelidir. Eğer LVEF bozukluğu 4 hafta içinde düzelmezse veya semptomatik kardiyomiyopati gelişirse tedavi kalıcı olarak sonlandırılmalıdır.
-
Hafif Karaciğer Yetmezliği Olan Hastalar İçin Doz Ayarlaması Gerekmez
- Orta veya şiddetli karaciğer yetmezliği olan hastalarda doz, günde iki kez 30 mg’a düşürülmelidir.
-
Böbrek Yetmezliği Olan Hastalar İçin Doz Ayarlaması Gerekmez
- Hafif, orta veya şiddetli böbrek yetmezliği durumlarında doz azaltılması gerekli değildir.
-
Görme Bozukluğu Riski Hakkında Bilgilendirme
- Hastalar, tedavi sırasında görme bozukluğu (örneğin bulanık görme) yaşayabilecekleri konusunda uyarılmalıdır. Seröz retinopati veya retina ven tıkanıklığı gibi ciddi durumların gelişimini izlemek için düzenli göz muayeneleri yapılmalıdır.
-
Kanama Belirtilerinin İzlenmesi
- Tedavi sırasında ve sonrasında hastalarda kanama belirtileri dikkatlice izlenmelidir. Özellikle rektal kanama gibi semptomlar ortaya çıkarsa, hızlı müdahale gereklidir.
-
Yeni Kanserlerin Gelişme Riski
- Tedavi sırasında hem deriyle ilişkili hem de deri dışı yeni primer kanserlerin gelişme riski artabilir. Tedavi sonlandıktan sonra 6 aya kadar bu risk devam edebileceği için hastalar yakından izlenmelidir.
-
Karaciğer Fonksiyon Testlerinin İzlenmesi
- Tedavi sırasında periyodik olarak karaciğer fonksiyon testleri yapılmalıdır. Bu, hepatotoksisite riskini kontrol altında tutmak için önemlidir.
-
Güneş Işığından Korunma
- Hastalar, güneş ışığına maruziyetten kaçınmalı ve ciltlerini koruyucu önlemler almalıdır. Bu, cilt toksisitesini önlemek için hayati önem taşır.
-
Kas Enzim Düzeylerinin İzlenmesi (CPK Değerlendirmesi)
- Tedavi sırasında rabdomiyoliz (kas yıkımı) riski nedeniyle kreatin fosfokinaz (CPK) düzeyleri düzenli olarak izlenmelidir. Rabdomiyoliz belirtileri görüldüğünde tedaviye ara verilmelidir.
-
FDA Onaylı BRAF Testi Kullanımı
- BRAF-V600E veya V600K mutasyonlarının varlığını doğrulamak için FDA onaylı bir tanı testi kullanılmalıdır. Bu, ilacın yalnızca uygun hastalara verilmesini sağlamak için gereklidir.
-
Embriyo-Fetal Toksisite Riski
- İlacın fetüs üzerindeki olumsuz etkileri nedeniyle doğurganlık çağındaki kadınlar etkili doğum kontrol yöntemleri kullanmalıdır. Tedavi süresince ve son dozdan sonra en az 30 gün boyunca gebelikten kaçınılmalıdır. Ayrıca, tedavi sırasında ve son dozdan sonra 3 gün boyunca emzirme yapılmamalıdır.
-
Kan ve Kas Dokusu ile İlgili Toksisite Riski
- Tedavi sırasında kanama komplikasyonları, hematolojik toksisite ve rabdomiyoliz gibi ciddi yan etkiler gözlenebilir. Bu tür toksisitelerle başa çıkmak için uygun klinik izlem yapılmalıdır.
Yan Etkiler
En sık olandan en seyrek olana göre yan etkiler şu şekilde bildirilmiştir:
- Kardiyak Toksisite: Kardiyomiyopati ve sol ventrikül fonksiyon bozukluğu.
- Oküler Toksisite: Görme bozukluğu, retina dekolmanı ve retinal ven tıkanıklığı.
- Gastrointestinal Toksisite: İshal, bulantı, kusma ve abdominal ağrı.
- Deri Toksisitesi: Döküntü, dermatit.
- Hepatotoksisite. Karaciğer fonksiyon testlerinde (ALT, AST) yükseklik.
- Kanama Komplikasyonları: Rektal kanama, hematokezya.
- Venöz Tromboembolik Olaylar: Derin ven trombozu ve pulmoner emboli.
- Rhabdomiyoliz: CPK düzeylerinde artış.
- İnterstisyel Akciğer Hastalığı.






