BRAF mutasyonu pozitif 4. evre akciğer kanseri tedavisi için yeni bir tedavi FDA onayı adı
BRAF V600E mutasyonu pozitif 4. evre - metastatik küçük hücreli dışı akciğer kanseri tedavisi için dabrafenib ve trametinib (piyasa adları Tafinlar ve Mekinist) kombinasyonu FDA tarafından onaylandı.
Kanser hücresel seviyede genetik değişimlerin tetiklediği bir hastalık grubudur. Vücudumuzdaki organ sayısı kadar ana kanser türü olmakla birlikte, her organ kanserinin de çok sayıda alt türü vardır. Eskiden sadece kanser hücrelerinin mikroskop altındaki görünümlerine bakılarak yapılan alt tür ayırımı, günümüzde kanser hücrelerinin genetik özellikleri (bazı özel DNA mutasyonları) aranarak ve saptanarak yapılmaktadır. Yani onkoloji çok daha hassaslaşmaktadır. Bu kanserleşmeyi tetikleyen DNA mutasyonlarını hedef alan tedavilere de akıllı ilaç diyoruz. 22 Haziran 2017’de FDA tarafından verilen onay hassas tıp adına önemli bir gelişmedir.
BRAF V600E mutasyonu pozitif akciğer kanseri tedavisi için, ilk defa bir ilaca Amerikan Gıda ve İlaç Dairesi - FDA onay vermiştir.
BRAF mutasyonu nedir? Bu genetik değişimi hedef alan ilaçların etki mekanizması nasıldır?
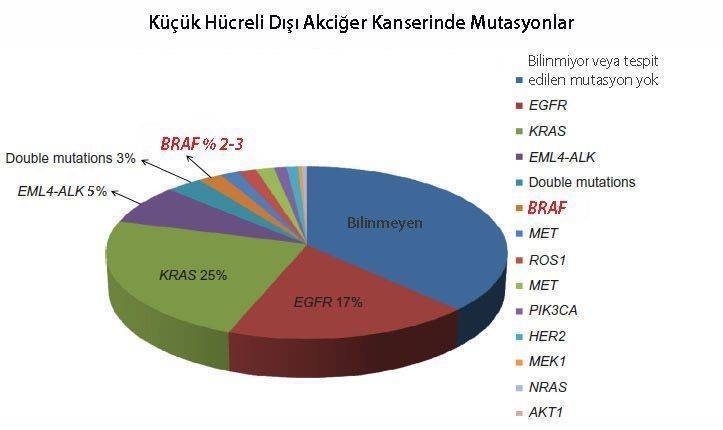
BRAF, B-Raf adlı proteini kodlayan bir insan genidir. B-Raf proteini, hücre içinde büyümeden sorumlu bir sinyal iletiminde görev alır (bakınız şekil). İlk olarak 2002’de, bazı insan kanserlerinde BRAF geninin mutasyonları sonucu hatalı B-Raf proteinleri tespit edilmiştir. Agresif bir cilt kanseri olan melanomda BRAF mutasyonlarını hedef alan vemurafenib ve dabrafenib daha önce FDA onayı almıştı. Sonraki çalışmalar melanom dışında kolon ve rektum kanseri, tiroid kanseri ve küçük hücre dışı akciğer kanserlerinde de belli oranlarda BRAF mutasyonları olduğunu göstermiştir.

Dabrafenib ve trametinibe akciğer kanseri tedavisinde FDA onayı getiren çalışma
BRAF V600E mutasyonu pozitif 93 küçük hücre dışı akciğer kanserli hastanın dahil edildiği, uluslarası, çok merkezli ve tek kollu bu çalışmada hastalara dabrafenib (günde 2 kez 150 mg) ve trametinib (günde 1 kez 2 mg) adlı kanser ilaçları ağızdan hap şeklinde uygulandı. Hastaların 36’sı daha önce metastatik akciğer kanseri tedavisi için herhangi bir sistemik tedavi almaz iken, 57’si en az bir basamak platin kemoterapisi temelli tedavi almıştı. 78 hasta ise daha önce BRAF mutasyonu hedefli dabrafenibi tek ilaç olarak kullanmıştı.
Daha önce platin bazlı kemoterapi alan grupta tedaviye yanıt verme oranı %63, ortanca tedaviye yanıt süresi 12.6 ay bulunmuştur. Daha önce tedavi almamış grupta tedaviye yanıt verme oranı %61, ortanca tedaviye yanıt süresine ise, hastaların çoğunun yanıtı devam ettiği için ulaşılmamıştır. Daha önce tek başına dabrafenib alanlarda tedaviye yanıt oranı %27 ve ortanca yanıt süresi 9.9 ay bulunmuştur.
Bu ilaçlara bağlı en yaygın gözüken (>%20) yan etkiler ateş, halsizlik, bulantı-kusma, ishal, cilt kuruluğu, iştah azalması, ödem, döküntü, kanama, öksürük ve solunum sıkıntısı-dispne olarak tespit edilmiştir.
Küçük hücre dışı akciğer kanseri tedavisi için bu ilaçların kullanılması için, öncelikle akciğer tümörü biyopsi dokusunda moleküler patolojik test ile BRAF V600E mutasyonu pozitifliği gösterilmelidir. FDA onayını takiben bu ilaçların akciğer kanserinde kullanımı hakkında daha çok bilgi edinileceğiz ve önümüzdeki dönemde ülkemizde onay alması halinde gelişmeyi sizlerle paylaşacağız.
fda-gov






