Daha hassas bir tıbbın zamanı gelmedi mi? Kanser ve hassas tıp
Kanserin tarihi insanlık tarihinden bile eskiye dayanır. İnsanlarda bilinen en eski kanser kanıtları ise Mısır mumyalarında yapılan analizlerde, fosilleşmiş kemik tümörlerinde bulunmuştur. İnsanoğlu kanserin mekanizmasını anlamaya yönelik çalışmalar içinse 19. yüzyıla kadar beklemek zorunda kalmıştır, öyle ki 1845’te kanser hücrelerinin mikroskop altında görüntülenmeye başlanması modern kanser tedavilerinin kapısını açmıştır. Kanserin tarihi böylesine eskiyken, moleküler ve hücresel düzeyde tedavi stratejileri geliştirmemiz çok yenidir.
Onkoloji diğer bilim dallarının etkisiyle hızlı bir gelişme göstermesine karşın, tüm kanserleri tedavi edecek tek bir ilaç henüz keşfedilememiştir. Bunun sebebi kanserin heterojen (karma) grup bir hastalık olmasıdır. Bir başka deyişle, kanser hücreleri hastadan hastaya değişiklik göstermesinin yanında, aynı hastada bile farklı genetik yapıda kanser hücreleriyle karşılaşmak mümkündür. Bu yüzden, kanser tedavisinde her kalıba uyan bir yaklaşım mümkün değildir. Son yıllarda genetik biliminin gelişmesiyle kanser tedavilerinde hassas tıp (precision medicine & oncology) önem kazanmaya başlamıştır. Daha önceleri hassas tıp yerine kişisel, bireysel veya kişiye özgü tedavi gibi terimler kullanılmaktaydı. Fakat aynı kişi içinde bile kanser hücrelerinin genetik yapısının ve dolayısı ile biyolojik davranışının farklılık gösterebildiğinin keşfedilmesi daha hassas yaklaşımlara ihtiyaç olduğunu gösterdi. Böylece, hücresel düzeyde genetik farklılıkların analiz edilmesi prensibine dayanan hassas tıp doğdu.
Hassas tıp, hastanın ve kanserinin genetik yapısına bağlı olarak, en doğru ve etkili tedaviyi bulmaya çalışır
Hassas tıbbın, klinikte ne ölçüde fayda sağlayabileceği sıklıkla tartışılan konulardan biridir. Hassas tıbbın kanser tedavilerinde etkili bir şekilde kullanılabileceğine dair kanıtlar bulunmaktadır. Bunlar;
1. Hassas tıp ile birlikte geleneksel kemoterapiye oranla daha fazla hastanın fayda görmesi
Hedefe yönelik tedavi alan bazı kanser hastalarında yaşam süresi oldukça uzamıştır. Örneğin, kronik miyeloid lösemi (KML) hastalarında keşfedilen Bcr-abl gen füzyonu (bir çeşit mutasyon), hedefe yönelik ilacın geliştirilmesini sağlamıştır. BCR-ABL’yi hedef alan imatinib adlı ilaç kronik miyeloid lösemi hastalarında yaşam süresini 5 yıl için yüzde 90 ve 8 yıl için yüzde 88 artırmıştır. Hemen hemen tüm kronik miyeloid lösemi hastalarında görülen bu gen bozukluğuna karşı geliştirilen tedavi, “hassas tıbbın” bir sonucudur. Diğer bir örnek ise HER2 pozitif meme kanserlerine karşı geliştirilen trastuzumab, lapatinib, pertuzumab gibi ilaçlardır.
Trastuzumab’ın (Herceptin) klasik kemoterapiyle birlikte kullanılması ölüm riskini yüzde 20 düşürmüştür. Aynı zamanda hastalığı ilerleyişini yavaşlatmış ve yaşam süresini belirgin ölçüde artırmıştır.
2. Hassas tıbbın kanserin genetik yapısına uygun yeni tedavi stratejileri sunması
Hassas tıp aynı zamanda kanserin zayıf noktalarını belirlemeye ve bu duruma uygun ilaçlar kullanmayı amaçlar. Yapay öldürücülük (synthetic lethality) kanserin zayıf noktasını hedef alan en önemli stratejilerden biridir. Bu strateji temelde genlerin etkileşimine dayanır. Örneğin, bir kanser hücresinde iki veya daha fazla genin aynı anda inaktif olması kanser hücresinin ölümünü tetiklerken, bu genlerden sadece birinin inaktif halde olması kanser hücresinin yaşamasını destekler. Araştırmacılar, bu tip etkileşimli genleri tespit ederek ilaçlar geliştirmeye çalışmaktadır. 2005 yılında, BRCA geni ile poly ADP ribose polymerase (PARP) genleri arasında böyle bir ilişki tespit edilmiştir. 2014 yılında Amerika Gıda ve İlaç Dairesi FDA, BRCA mutasyonuna sahip over kanseri hastalarında, PARP inhibitörü Olaparib’in kullanılmasını onaylamıştır.
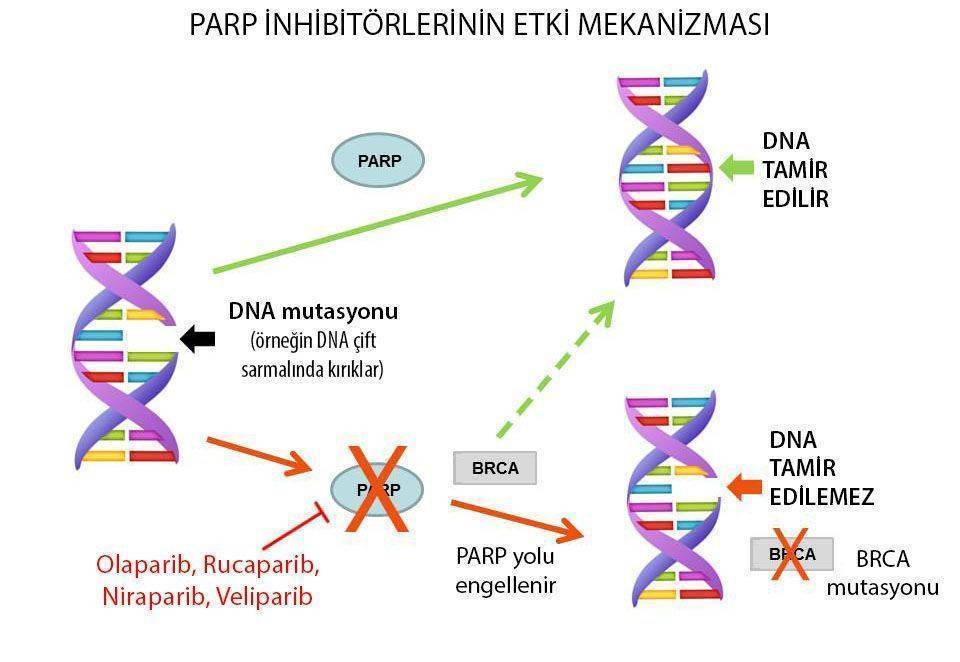
Bu durumu basitçe açıklamak gerekirse, BRCA ve PARP genleri DNA hasarlarının tamirinde görev alırlar. Bu genlerden sadece birisi bozuksa, kanser hücresi yaşamına devam eder. Ancak ikisi de bozulursa kanser hücresi DNA tamirini etkili bir şekilde gerçekleştiremez. Araştırmacılar BRCA geni bozuk olan hastalarda, PARP genini hedef alarak kanser hücrelerini yok etmeyi başarmışlardır. Şu anda benzer ilişkilere sahip olan genler keşfedilmekte ve ilaç geliştirilmektedir. Kanser hücresinin büyümesini destekleyen önemli proteinlerden biri demyc’tir. Bu proteinlere karşı geliştirilen ilaçlar şu an faz-1 klinik çalışmalarda denenmektedir.
3. Hassas tıp, en yeni genetik mühendisliği teknolojilerini kullanır
Hassas tıp, genetik bilimiyle koordineli biçimde çalışır. Devrim yaratan genetik mühendislik teknolojilerinden biri olan crispr ile birlikte DNA’da istenilen değişiklikler yapılabilir ve böylelikle hastanın kanser hücresinde meydana gelen mutasyonlar taklit edilebilir. Bu durum yeni ilaçların geliştirilmesinde büyük kolaylık sağlar. Bunun yanında, CRISPR/CAS9 genetik teknolojisi ile bağışıklık sistemi hücreleri değiştirilerek, hastanın kanser hücresine daha etkili saldıracak şekilde programlanabilmektedir. Farklı kanser türlerinde klinik çalışmalar başlamıştır.
Hassas tıp da kullanılan bir diğer yeni teknoloji ise Cryo elektron mikroskobudur. Bu yöntem protein ve benzeri molekülleri dondurarak inceleme imkanı sunmaktadır. Böylelikle, ilaçlara verilen tepki ve hastadaki mutasyonlar daha iyi bir şekilde görülebilmektedir.
Hassas tıpta karşılaşılan sorunlar nelerdir?
- Hassas tıbbın önündeki en büyük engel, tüm kanser türlerini hesaba katarsak, günümüzde hedeflenebilecek anlamlı genetik mutasyonun bulma oranının sadece %30-40’larda kalmasıdır. Bunun yanında tümörde bazı mutasyonlar bulunsa bile, bu mutasyonların normal dokuda da olup olmadığı netleştirilmelidir (günümüzde rutin pratikte normal dokuda biyopsi yapılmadığı için bu karşılaştırma da yapılamamaktadır). Ayrıca elimizde her mutasyon için hedefe yönelik ilaç da geliştirilmiş değildir.
- Diğer iki büyük zorluk ulaşılabilirlik ve maliyettir. Hedefe yönelik ilaçlar uygulayabilmeniz için genetik testler yapmanız gerekir. Ancak genetik testlerin maliyeti şu an için yüksektir. Aynı zamanda, genetik testlerin güvenilirliği için iyi bir merkezde yapılması gerekir. Bunun yanı sıra hedefe yönelik ilaçların fiyatlarının yüksek olması da hastalara ulaştırılmasını zorlaştırmaktadır.
- Hassas tıbba yöneltilen eleştiriler klinik araştırmalardaki yetersizlikleri de içerir. Hedefe yönelik ilaçlara erişmede zorluk ve belirli tümör örneklerine ulaşamamak az katılımlı klinik çalışmaların gerçekleştirilmesine neden olmaktadır. Bu problemlerin önüne geçmek amacıyla yeni klinik çalışma dizaynları tanımlanmaya başlamıştır:
- NCI-MATCH denilen sistemde hastalar tümör histolojisine (mikroskop altınd görünüm) göre değil de genetik yapılarına göre tedavi seçimi yapılarak klinik çalışmalara alınır. Kontrol grubu olmaması bu dizaynın önemli eksikliklerinden biridir.
- NCI-MPACT de ise tetikleyici mutasyonlar hedef alınır. Bu tip klinik çalışmalara DNA tamir, PI3-K/mTOR ve Ras/Raf/MEK gibi hücresel yolakların herhangi birinde genetik bozukluklara sahip ileri evre kanser hastaları alınır. Tetikleyici mutasyona sahip olmayan hastalar klinik çalışmaya dahil edilmemektir.
Önemle vurgulamak gerekir ki, kanserin temel sebebi gen hasarlarıdır. Bu gen hasarları hastadan hastaya, hatta aynı hastanın farklı organlarında bile değişiklik göstermektedir. Bu farklılıkları belirleyerek tedavi planlaması gerçekleştirmeye çalışan hassas tıp, gelecekte kanser tedavilerinin temel prensibini oluşturacaktır.
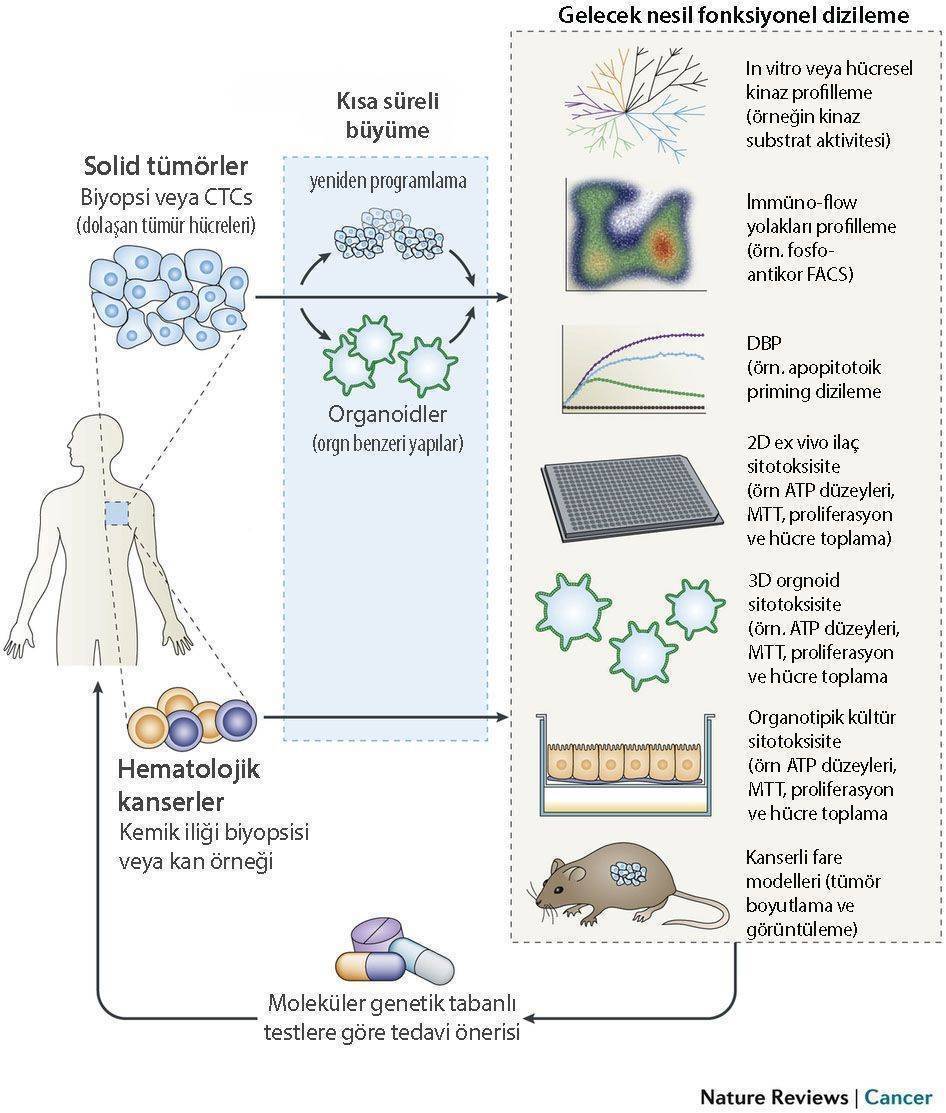
Aşağıdaki şekilde moleküler genetik tabanlı testlerde kullanılan yöntemler şematize edilmiştir.
1. Seung Ho Shin,
Precision medicine: the foundation of future cancer therapeutics,
npj Precision Oncology, Article number:12. 2017
2. Adam A.Friedman,
Precision medicine for cancer with next generation functional diagnostics,
Nature Reviews Cancer,2015