Evre-3 Akciğer Kanserinde Kemoradyoterapi Sonrası Osimertinib FDA Onayı Aldı
25 Eylül 2024 tarihinde, ABD Gıda ve İlaç Dairesi (FDA), platin bazlı kemoradyoterapi sırasında veya sonrasında hastalığı ilerlemeyen ve tümörlerinde EGFR exon 19 delesyonları veya exon 21 L858R mutasyonları bulunan lokal olarak ilerlemiş, ameliyat edilemeyen (evre 3) küçük hücreli dışı akciğer kanseri (KHDAK) olan hastalar için osimertinibi (Tagrisso, AstraZeneca) onayladı.
Bu onayla birlikte osimertinib, belli EGFR mutasyonlarına sahip akciğer kanserlerinin tüm evrelerinde FDA onayı almış oldu.
Ameliyatla çıkarılamayan evre III küçük hücreli dışı akciğer kanseri, kanserin akciğer ve çevresindeki lenf bezlerine yayıldığı, ancak cerrahi müdahale ile tamamen çıkarılamadığı bir hastalık evresidir. Bu evrede, kanserin yayılımı nedeniyle cerrahi tedavi genellikle mümkün değildir ve tedavi seçenekleri genellikle kemoterapi, radyoterapi ve kemoradyoterapi sonrası durvalumab immünoterapisi gibi diğer yöntemlerle sınırlıdır.
EGFR Mutant 3. Evre Akciğer Kanserinde Kemoradyoterapi Sonrası İlk Onaylı Tedavi
EGFR mutasyonları, kanser hücrelerinin kontrolsüz büyümesini tetikleyerek kanserin hızla yayılmasına yol açan genetik değişikliklerdir. Osimertinib, özellikle EGFR exon 19 delesyonları veya exon 21 L858R mutasyonları bulunan KHDAK hastalarında tümör büyümesini inhibe eden üçüncü nesil bir tirozin kinaz inhibitörüdür.
FDA'nın osimertinib etken maddeli Tagrisso için yaptığı bu onay, EGFR mutant 3. evre küçük hücreli dışı akciğer kanseri hastalarında kemoradyoterapi sonrası ilerleme göstermeyen hastalar için onaylanan ilk tedavi olma özelliğini taşıyor.
Bu Çalışmaya Kadar
Bu çalışmaya kadar, ameliyatla çıkarılamayan EGFR mutant evre III küçük hücreli dışı akciğer kanseri (KHDAK) hastalarının kemoradyoterapi sonrası standart tedavisi durvalumab idi. Durvalumab, kemoradyoterapi sonrası 1 yıl boyunca immünoterapi olarak kullanılıyordu. Ancak, durvalumabın EGFR mutant hastalıkta etkisinin sınırlı olduğu ve bu hastalar için genellikle kullanılmadığı bilinmektedir. Bu nedenle, osimertinibin bu hasta grubunda daha etkili bir seçenek olabileceği düşünülmektedir.
LAURA Çalışması ile Gelen FDA Onayı
ASCO 2024'te ayakta alkışlanan LAURA çalışmasını 3 önemli nokta ile özetleyebiliriz:
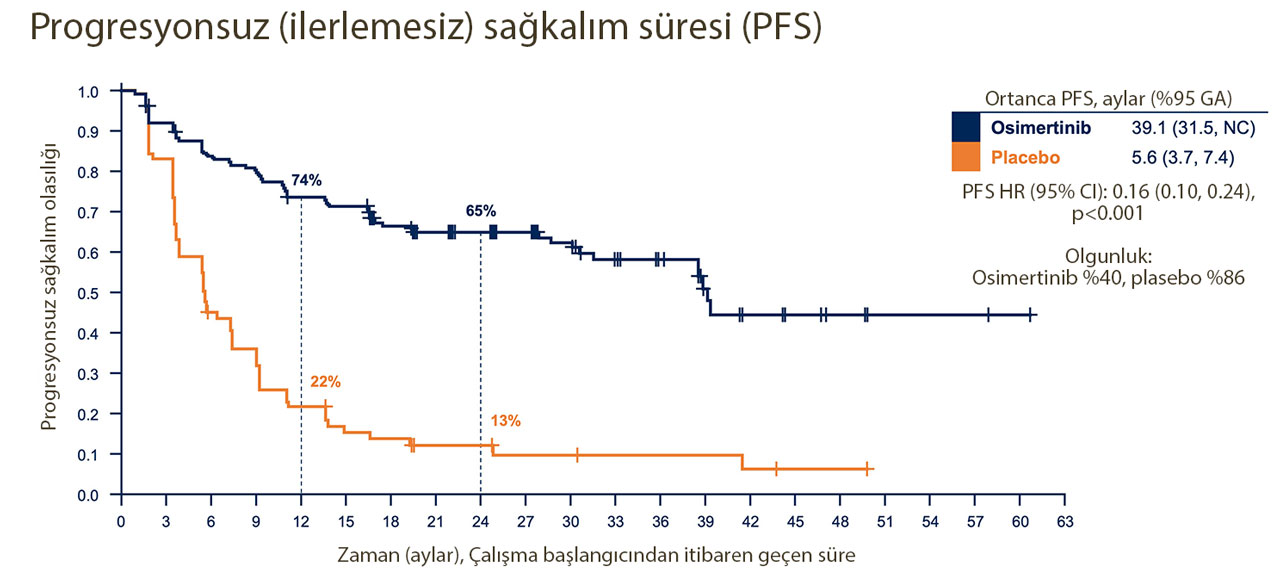
1. Progresyonsuz Sağkalımda Dramatik Artış:
LAURA çalışması, osimertinibin ameliyatla çıkarılamayan evre III EGFR pozitif küçük hücreli dışı akciğer kanseri (KHDAK) hastalarında ortanca progresyonsuz sağkalımı plaseboya kıyasla 33.5 ay uzatarak 39.1 aya çıkardığını gösterdi (39.1 aya karşılık 5.6 ay). Bu veriler, kanser ilerlemesi veya yaşam kaybı riskinde %84'lük bir azalma anlamına gelmektedir. Bu dramatik artış, hastaların yaşam kalitesini ve hayatta kalma sürelerini önemli ölçüde iyileştiriyor.
2. EGFR Mutant Hastalarda Yeni Standart Tedavi:
Çalışma sonuçları, EGFR mutant evre III KHDAK hastaları için kemoradyoterapi sonrası osimertinibin yeni standart tedavi haline getirdi. Durvalumabın EGFR mutant hastalığında sınırlı etkisi olduğu göz önüne alındığında, osimertinib bu hasta grubunda daha etkili bir tedavi seçeneği sunarak tedavi protokollerinde büyük bir değişim yaratıyor.
3. Beyin Metastazlarının Azalması:
Osimertinibin, çalışma süresince yeni lezyonlar ve özellikle beyin metastazlarının oluşumunu anlamlı derecede azalttığı gözlemlendi. Plasebo alan hastaların %29'unda beyin metastazı gelişirken, osimertinib alan hastalarda bu oran %8'de kaldı. Bu, hastaların yaşam kalitesini önemli ölçüde artıran bir bulgu olup, osimertinibin beyin metastazları üzerindeki koruyucu etkisini vurgulamaktadır.
Çalışmanın Detayları
Çalışmada, ilerlemeyen evre III EGFR-mutant KHDAK'li 216 hasta rastgele 80 mg osimertinib (143 hasta) veya plasebo (73 hasta) almak üzere randomize edildi. Başlangıç özellikleri, çalışma kolları arasında genellikle dengeli olup, evre III alt tipleri arasında çoğunlukla eşit bir dağılım gösterdi.
Hastalar, beyin metastazlarının olmadığını doğrulamak için biyopsi veya BT ve MRG ile evrelendirildi. Takip görüntülemeleri düzenli aralıklarla tekrarlandı.
12 aylık progresyonsuz sağkalım, kör bağımsız merkezi inceleme tarafından değerlendirildi ve osimertinib ile %74, plasebo ile %22 olarak bulundu. 24 ayda, oranlar sırasıyla %65 ve %13'tü.
Progresyonsuz sağkalım faydası birçok alt grup arasında sürdü, ancak istatistiksel olarak anlamlı yalnızca Asyalı bireyler arasında, her iki çalışma kolunun da %80'inden fazlasını oluşturan grupta idi.
Veriler olgunlaşmamış olsa da, osimertinib genel sağkalımda da iyileşme eğilimi gösteriyor, ancak plasebo hastalarının %81'inin progresyon sonrası osimertinibe geçmesi nedeniyle bu eğilim net değil. Olgun genel sağkalım sonuçlarının 2 yıl içinde bekleniyor.
Osimertinibin önerilen dozu, hastalık ilerleyene veya kabul edilemez toksisite ortaya çıkana kadar günde bir kez 80 mg’dır ve yiyeceklerle birlikte veya ayrı olarak alınabilir.
Sonuç ve Yorum
EGFR mutasyon testi "şimdi evre III hastalar için optimal tedaviyi sağlamak için kritik" br hal aldı. KHDAK'li hastaların neredeyse üçte biri evre III hastalıkla gelir ve çoğunluğu ameliyat edilemez. Bunların yaklaşık üçte biri EGFR mutasyonludur.
Plasebo, bu çalışmada adil bir karşılaştırıcıydı. Mevcut standart tedavi, kemoradyoterapi sonrası 1 yıl boyunca durvalumab kullanmaktır. Ancak durvalumab, EGFR-mutant hastalıklarda etkili olmadığı için genellikle bu durumda kullanılmaz.
Kontrol grubundaki hastalar durvalumab alsalardı, EGFR tirozin kinaz inhibitörünü (TKI) güvenli bir şekilde vermek için ilerlemeyi beklemeleri gerekecekti, bu da hastaların çıkarına uygun olmazdı.
Plasebo alan hastaların %68'i, çalışma sırasında yeni lezyonlar geliştirdi, bunların %29'u beyin metastazıydı. Osimertinib alanların %22'sinde yeni lezyonlar gelişti, bunların %8'i beyin lezyonuydu.
En yaygın yan etki olan radyasyon pnömonitisin sıklığı, osimertinib ile %48 ve plasebo ile %38 idi. Cilt döküntüsü, ishal ve diğer bilinen TKI yan etkileri de osimertinib ile daha yaygındı.
Tedaviye bağlı 3. derece veya daha kötü yan etkiler, osimertinib hastalarının %13'ünde ve plasebo hastalarının %3'ünde meydana geldi. Genel olarak, osimertinib hastalarının %8'inde interstisyel akciğer hastalığı gelişti; çoğu vaka düşük dereceydi, ancak bir kişi yaşamını kaybetti.
Yan etkiler nedeniyle hastaların yaklaşık yarısı osimertinib dozunu kesintiye uğrattı ve azınlıkta kesildi.
Uzun Süreli Tedavi ve Maliyet
Hastalar, önceki EGFR TKI çalışmalarında olduğu gibi sınırlı bir süre yerine, ilerlemeye kadar osimertinib ile tedavi edildi. Bu yaklaşım, belirsiz de olsa yaşam boyu tedavi olasılığını artırıyor.
İlerlemeye kadar tedavi, çoğu hasta için ameliyat edilemeyen evre III KHDAK'nin tedavi edilemeyeceği gerçeğini kabul eder. Ancak, az sayıda hasta tedaviye ihtiyaç duymayabilir ve bu durum önemlidir; çünkü ilaç, aylık yaklaşık 180 bin TL bir maliyete sahiptir.
Sonuç olarak osimertinib, ameliyatla çıkarılamayan evre III EGFR-mutant KHDAK tedavisinde önemli bir ilerleme kaydetmiştir. LAURA çalışmasının sonuçları, osimertinibin bu hastalarda progresyonsuz sağkalımı belirgin şekilde uzattığını ve yeni standart tedavi olarak kabul edildiğini göstermektedir. Bu sonuçlar, hastaların yaşam kalitesini artırmak ve tedavi seçeneklerini genişletmek açısından büyük bir umut vadetmektedir. Ayrıca, beyin metastazlarının azalması ve genel sağkalım eğilimindeki iyileşme, osimertinib'in bu hasta grubundaki etkinliğini daha da pekiştirmektedir.
FDA approves osimertinib for locally advanced, unresectable (stage III) non-small cell lung cancer following chemoradiation therapy. 25 Sep 2024. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-osimertinib-locally-advanced-unresectable-stage-iii-non-small-cell-lung-cancer






