İmmünoterapi pembrolizumab, ileri evre baş-boyun kanserli hastaların birinci basamak tedavisi için FDA onayı aldı
10 Haziran 2019'da, ABD Gıda ve İlaç İdaresi (FDA), metastatik veya ameliyatla çıkarılamayan tekrarlayan baş ve boyun skuamöz (yassı) hücreli kanserli hastaların birinci basamak tedavisi için pembrolizumab (Keytruda) adlı immünoterapi ilacını onayladı.
Pembrolizumab, PD-L1 düzeyi ≥1 (Kombine Pozitif Skor [CPS] ≥1) olan tüm hastalar için platin ve florourasil (FU) ile kombine ve tek bir ajan olarak kullanım için onaylandı.
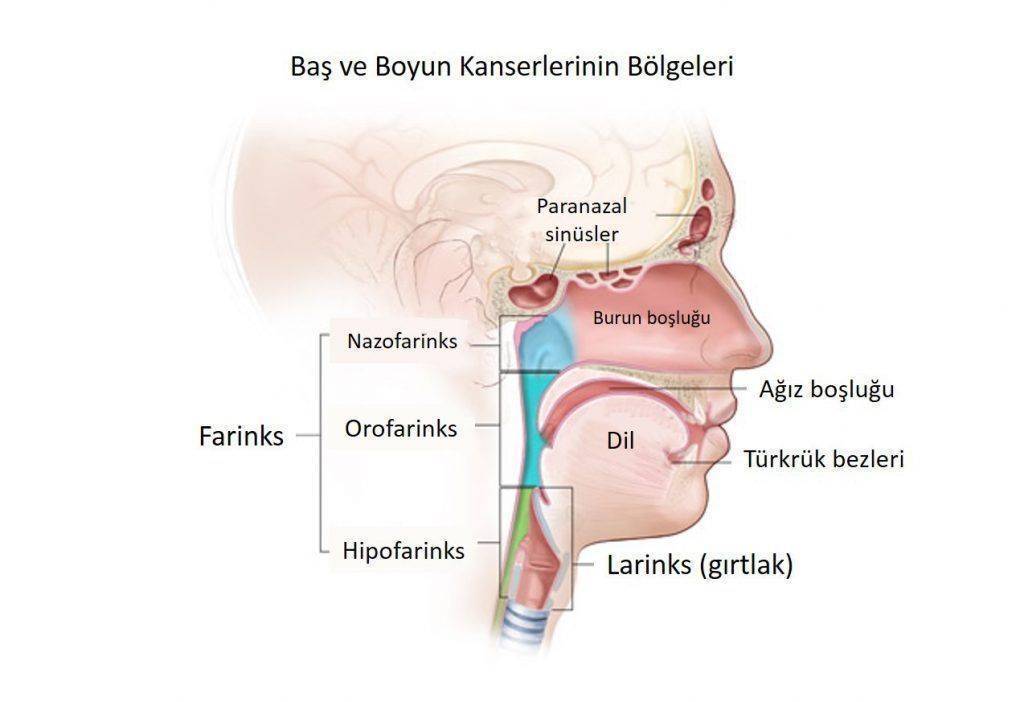
Aşağıdaki resimde, baş ve boyun kanserlerinin ortaya çıkabileceği anatomik bölgelerin sınıflandırması görülebilir:
KEYNOTE-048 Çalışması
Onay, daha önce metastatik ya da tekrarlayan hastalık için sistemik tedavi almamış yassı hücreli baş-boyun kanserli 882 hastada yapılan randomize, çok merkezli, üç kollu, açık etiketli, aktif kontrollü KEYNOTE-048 adlı klinik araştırmaya dayanıyordu.
Hastalar aşağıdaki tedavilerden birini almak için 1:1:1 oranında rastgele 3 kola ayrıldı:
- Tek bir ajan olarak pembrolizumab
- Pembrolizumab, karboplatin veya sisplatin ve FU
- Setuksimab, karboplatin veya sisplatin ve FU
Hastalar ayrıca;
- PD-L1 pozitifliği (Tümör Oranı Skoru [TPS] ≥% 50 veya <% 50),
- HPV durumu (pozitif veya negatif) ve
- ECOG performans skoru (0 vs. 1) durumlarına göre alt gruplara ayrıldı.
Çalışmanın ana etkinlik ölçütü, genel sağkalım idi.
Çalışma sonucunda;
- Setuksimab artı kemoterapi ile karşılaştırıldığında pembrolizumab artı kemoterapiy alan hastalar için genel sağkalımda istatistiksel olarak anlamlı bir gelişme olduğunu gösterdi.
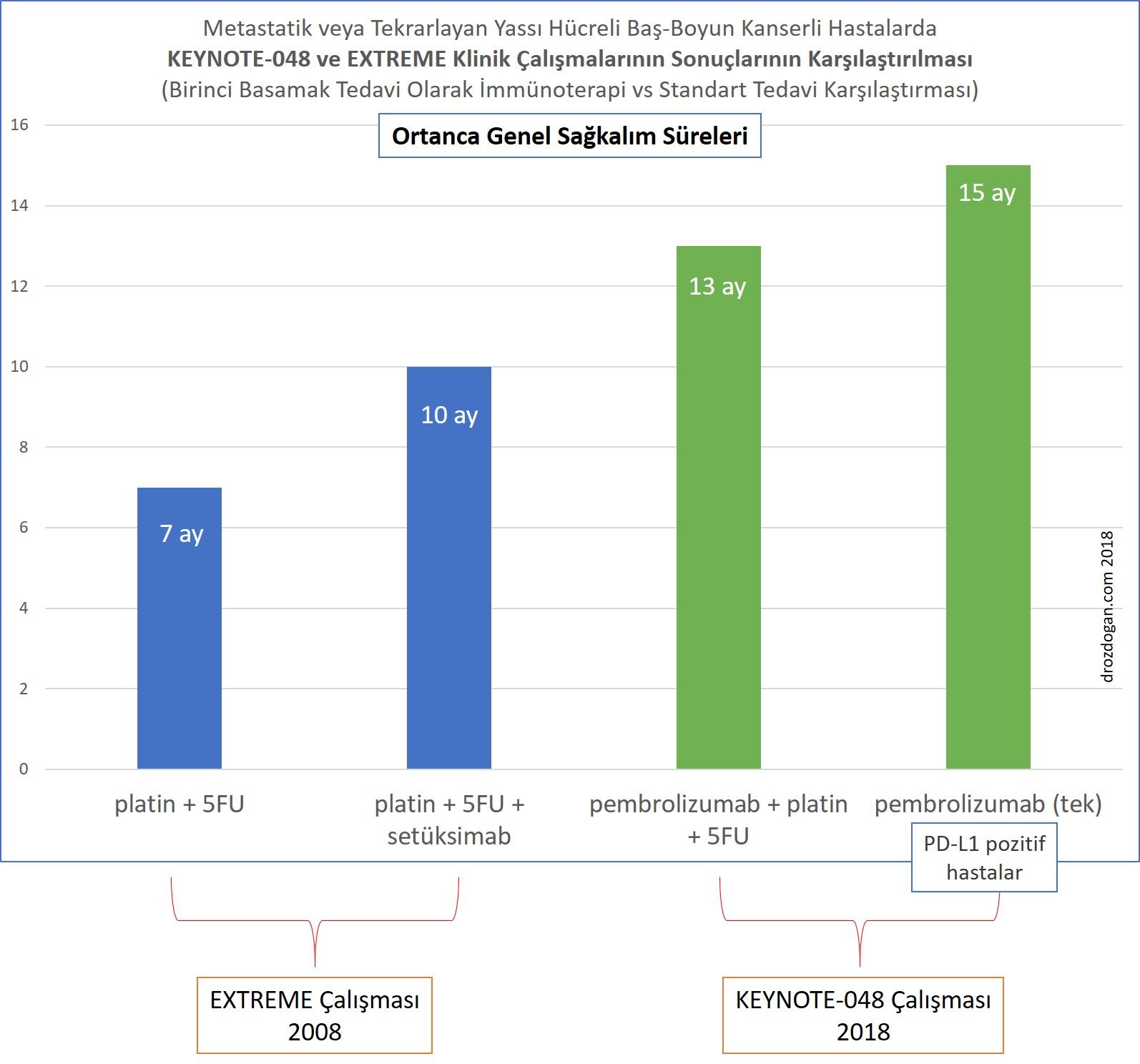
- Ortanca genel sağkalım pembrolizumab artı kemoterapi kolu için 13.0 ay ve setuksimab artı kemoterapi kolu için 10,7 aydı (HR 0.77;% 95 CI: 0.63, 0.93; p = 0.0067).
- Sonuçlar PD-L1 ≥20 alt grubunda PD-L1 ≥1 alt grubunda benzerdi.
- Setuksimab artı kemoterapi ile karşılaştırıldığında tek bir ajan olarak pembrolizumab PD-L1 ≥1 ve PD-L1 ≥20 olan yassı hücreli baş-boyun kanserli hasta alt grupları için genel sağkalımda istatistiksel olarak anlamlı gelişmeler gözlendi. PD-L1 ≥1 alt grubunda, ortanca genel sağkalım pembrolizumab kolu için 12.3 ay ve setuksimab artı kemoterapi kolu için 10.3 aydı (HR 0.78;% 95 CI: 0.64, 0.96; p = 0.0171). PD-L1 ≥20 alt grubu için ortanca gene sağkalım pembrolizumab kolu için 14.9 ay ve setuksimab artı kemoterapi kolu için 10.7 aydı (HR 0.61;% 95 CI: 0.45, 0.83; p = 0.0015).
- Herhangi bir alt grupta, setuksimab artı kemoterapi koluna kıyasla pembrolizumab içeren kol için progresyonsuz (ilerlemesiz) sağkalımda anlamlı bir farklılık yoktu.
Yan etkiler
KEYNOTE-048'de tek ajan olarak pembrolizumab alan hastaların ≥ %20'sinde en sık görülen yan etkiler yorgunluk, kabızlık ve döküntüdür. KEYNOTE-048'de kemoterapi ile birlikte pembrolizumab alan hastaların ≥ %20'sinde en sık görülen ya etkiler bulantı, yorgunluk, kabızlık, kusma, mukozal inflamasyon, ishal, iştah azalması, stomatit ve öksürük idi.
Yassı hücreli baş-boyun kanserli hastalar için önerilen pembrolizumab dozu, hastalığın ilerlemesi veya kabul edilemez yan etki olmayan hastalarda 24 aya kadar her 3 haftada bir 30 dakikada bir intravenöz (toplardamardan) infüzyon halinde verilen 200 mg'dır.
Birinci basamakta immünoterapinin aktivitesini gösteren bu çalışma, 2008 yılında NEJM'de yayımlanan ve metastatik veya tekrarlayan baş boyun kanserli hastaların mevcut standart tedavisini tanımlayan EXTREME çalışması ile karşılaştırılabilir. EXTREME çalışması ilk olarak platin + 5FU + setüksimab üçlü rejiminin, platin + 5FU ikili rejimine üstün olduğunu gösteren bir çalışma idi ve bu grup hastaların ortanca yaşam beklentilerini 7 aydan 10 ay gibi bir süreye çıkarmıştı.
Şimdi, baş-boyun kanserleri tarihinde köşetaşı niteliğindeki bu iki çalışmanın sonuçlarını karşılaştıracak olursak;
İlgili Konu:
- 4. evre veya tekrarlayan baş-boyun kanserinin en iyi başlangıç tedavisi nedir?