
PIK3CA Mutasyonlu Hormon Pozitif Meme Kanseri için İnavolisib FDA Onayı Aldı
10 Ekim 2024 tarihinde, Amerikan Gıda ve İlaç Dairesi (FDA), hormonal tedaviye dirençli, PIK3CA mutasyonlu, hormon reseptörü (HR)-pozitif, insan epidermal büyüme faktörü reseptörü 2 (HER2)-negatif, lokal ileri veya metastatik meme kanseri olan yetişkin hastalar için inavolisib (Itovebi, Genentech, Inc.) adlı ilacı, palbosiklib ve fulvestrant ile birlikte onayladı. Bu onay, FDA onaylı bir test ile tespit edilen PIK3CA mutasyonu olan hastaları kapsamaktadır ve adjuvan endokrin tedavi sonrasında veya tedavi sırasında nüks eden hastalarda kullanılabilecektir.
FDA ayrıca, inavolisib ile palbosiklib ve fulvestrant tedavisi için uygun hastaların belirlenmesi amacıyla FoundationOne Liquid CDx testi adlı tanı cihazını da onayladı.
Daha önce 2019'da PIK3CA mutasyonuna sahip meme kanserlerinin tedavisinde alpelisib etken maddeli Pimreva adlı ilaç FDA onayı almıştı. Benzer durumdaki hastaların tedavisi için yeni FDA onayı alan inavolisib etken maddeli Itovebi ise hem etkinlik hem de yan etkiler bakımından alpelisibden farklı özellikler taşıyor.
PIK3CA Mutasyonu Nedir? Meme Kanseri için Önemi
HR pozitif, HER2-negatif meme kanserlerinin %40'ında PIK3CA mutasyonu bulunur.
Bu mutasyon, kanserin gelişimini ve tedaviye karşı direncini etkileyen önemli bir faktördür. Bu onaydan önce, PIK3CA mutasyonunu hedefleyen tek onaylı tedavi, bir PI3K inhibitörü olan alpelisib idi.
PI3K inhibitörleri, hücrelerin enerji üretimi ve büyümesinde kritik bir rol oynayan PI3K yolunu bloke eder. PIK3CA genindeki mutasyonlar bu yolu aşırı aktif hale getirir, bu da kanser hücrelerinin kontrolsüz şekilde büyümesine ve hayatta kalmasına katkı sağlar. PI3K inhibitörleri bu yolu bloke ederek kanser hücrelerinin çoğalmasını durdurmayı ve onları yok etmeyi amaçlar.
PIK3CA genindeki mutasyonlar, farklı PI3K protein formlarının, yani izoformların oluşmasına neden olur. PI3K'nın birkaç izoformu vardır ve bunlardan biri alfa izoformudur. Alpelisib, özellikle bu alfa izoformunu hedef alır ve bu sayede kanser hücrelerini baskılar. Ancak, bu hedefleme mekanizması nedeniyle alpelisib, ciddi yan etkilere, özellikle yüksek kan şekeri seviyelerine ve ciddi cilt reaksiyonlarına (döküntü ve kabarcıklar gibi) neden olabilir.
İnavolisib ise alfa izoformunu hedeflemesinin yanı sıra, bu izoformun mutant formlarına da etki eder. Araştırmacılar, inavolisibin alpelisibe kıyasla daha az şiddetli yan etkilere sahip olabileceğini düşünmektedirler.
INAVO120 Çalışması ile Gelen FDA Onayı
İnavolisibin etkinliği, INAVO120 adlı randomize, çift kör, plasebo kontrollü, çok merkezli bir çalışmada değerlendirildi.
Çalışmanın en önemli sonucu olarak, palbosiklib ve fulvestrant tedavisine inavolisib eklenmesi, sadece palbosiklib artı fulvestrant tedavisine kıyasla progresyonsuz sağkalım süresini (PFS), iki katından fazla uzattı.
Çalışmaya, endokrin dirençli, PIK3CA mutasyonlu, HR-pozitif, HER2-negatif, lokal ileri veya metastatik meme kanseri olan 325 hasta dahil edildi. Bu hastaların hastalığı, adjuvan endokrin tedavi sırasında veya bu tedavinin tamamlanmasından sonraki 12 ay içinde ilerlemişti ve daha önce lokal ileri ya da metastatik hastalık için sistemik tedavi almamışlardı. Birincil endokrin direnç, adjuvan endokrin tedavinin (ET) ilk 2 yılı içinde nüks olarak tanımlanırken, ikincil endokrin direnç, adjuvan ET'den en az 2 yıl sonra veya tedavinin tamamlanmasından sonraki 12 ay içinde nüks olarak tanımlandı.
Hastalar, inavolisib 9 mg veya plasebo almak üzere 1:1 oranında randomize edildi. Her iki grup da 125 mg palbosiklibi 21 gün boyunca günde bir kez oral olarak aldı ve ardından 7 gün tedaviye ara verildi (bu, 28 günlük bir tedavi döngüsünü oluşturdu). Ayrıca, fulvestrant 500 mg, 1. döngünün 1. ve 15. günlerinde, ardından her 28 günlük döngünün 1. gününde intramüsküler olarak uygulandı.
Hastalar, kanser büyüyene veya kabul edilemez yan etkiler gelişene kadar tedaviyi aldılar.
Bu 325 hastanın, hormonal tedaviye dirençli olmaları dışında şu ilave yüksek risk özellikleri vardı:
- Hastaların %48'i menopoz öncesi dönemde idi.
- %80'inde visseral (iç organ) metastazı, %50'sinde karaciğer tutulumu vardı.
Diğer özellikler:
- %38 Asyalı.
- %48 yalnızca adjuvan tamoksifen kullanımı.
Sonuçlar
Çalışmanın ana etkinlik ölçütü, progresyonsuz sağkalım (PFS) idi. Ek etkinlik ölçütleri arasında genel sağkalım (OS), araştırmacı tarafından değerlendirilen objektif yanıt oranı (ORR) ve yanıt süresi (DOR) yer aldı.
Ortanca takip süresi 21.3 aydı. Bu, kişilerin yarısının daha uzun süre, diğer yarısının daha kısa süre takip edildiği anlamına gelir.
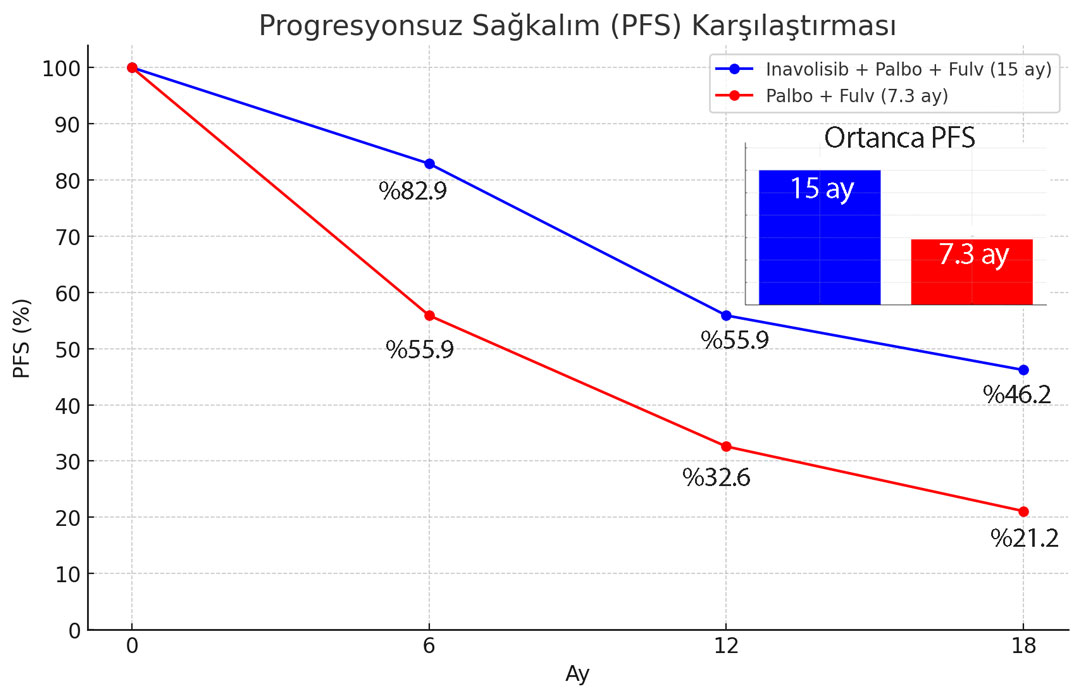
Ortanca takip süresinde, inavolisib ile palbosiklib ve fulvestrant alan kişilerde progresyonsuz sağkalım süresi, yalnızca palbosiklib ve fulvestrant alanlara kıyasla iki katından fazla uzundu. Progresyonsuz sağkalım:
- Inavolisib, palbosiklib ve fulvestrant alan kişilerde 15 ay
- Yalnızca palbosiklib ve fulvestrant alan kişilerde 7.3 ay
- Stratifiye edilmiş risk oranı (95% GA): HR 0.43 (0.32, 0.59) p<0.0001
- Inavolisib kolunda 6. ayda PFS oranı %82.9'a ulaşırken, kontrol kolunda bu oran %55.9 olarak tespit edildi. 12. ay itibarıyla, Inavolisib grubunda PFS %55.9 iken, kontrol grubunda %32.6'dır. 18. ay itibarı ile bu oran % 46.2'ye karşılık %21.2 idi.
Genel sağkalım bilgisi — kanser büyüse de büyümese de kişilerin ne kadar yaşadığı — henüz analiz edilmeye hazır değildi, ancak inavolisib alan kişilerde daha iyi genel sağkalım eğilimi vardı.
Inavolisibin palbosiklib ve fulvestrant ile kombinasyonu, PIK3CA-mutasyonlu, hormon reseptörü pozitif, HER2-negatif ileri evre meme kanseri hastaları için yeni bir standart tedavi olabilir.
Inavolisib Yan Etkileri
Sonuçlar, inavolisibin alpelisibden daha az şiddetli yan etkilere neden olacağı yönündeki araştırmacıların umutlarını gerçekleştirdiğini öne sürüyor.
Inavolisibin neden olduğu en yaygın (%25'ten fazla) yan etkiler:
- düşük beyaz kan hücresi sayımı
- ağız yaraları
- anemi
- yüksek kan şekeri seviyeleri
- ishal
- bulantı
- döküntü
Ve ağız yaraları, yüksek kan şekeri seviyeleri, ishal ve döküntü yaygın yan etkiler olmasına rağmen, çoğu kişi için ciddi değildi:
- %5.6'sında ciddi ağız yaraları vardı
- %5.6'sında ciddi yüksek kan şekeri seviyeleri vardı
- %3.7'sinde ciddi ishal vardı
- hiçbir kişide ciddi döküntü yoktu
İnavolisib, palbosiklib ve fulvestrant alan kişilerin sadece yaklaşık %7'si yan etkiler nedeniyle tedaviyi bıraktı.
İnavolisib için önerilen doz, günde bir kez aç veya tok karnına 9 mg oral olarak alınmasıdır. Tedavi, hastalık ilerleyene veya kabul edilemez bir toksisite gelişene kadar sürdürülmelidir. Palbosiklib ve fulvestrant doz bilgileri için ilgili reçete bilgilerine başvurulmalıdır.
FDA approves inavolisib with palbociclib and fulvestrant for endocrine-resistant, PIK3CA-mutated, HR-positive, HER2-negative, advanced breast cancer. 10 Oct 2024. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-inavolisib-palbociclib-and-fulvestrant-endocrine-resistant-pik3ca-mutated-hr-positive






