
RET Gen Füzyonları Pozitif Akciğer Kanseri için Pralsetinib FDA Onayı Aldı
Metastatik (4. evre) RET füzyon pozitif küçük hücreli dışı akciğer kanseri (KHDAK) olan yetişkin hastalar için pralsetinib (Gavretom) adlı akıllı ilaca, ABD Gıda ve İlaç İdaresi (FDA) 4 Eylül 2020'de hızlandırılmış onay verdi.
Eşzamanlı olarak FDA ayrıca, pralsetinib için yardımcı tanı olarak Oncomine ™ Dx Hedef (ODxT) Testini (Life Technologies Corporation) onayladı.
Güncelleme
9 Ağustos 2023'te, FDA, metastatik RET füzyon pozitifliği olan KHDAK olan yetişkin hastalar için pralsetinibe normal onay verdi. Pralsetinib, daha önce ARROW denemesinde kayıtlı 114 hastada başlangıç genel yanıt oranı ve yanıt süresi temel alınarak KHDAK endikasyonu için hızlandırılmış onay almıştı. Normal onaya dönüşüm, ek 123 hastadan ve yanıtın sürekliliğini değerlendirmek için ek 25 aylık takip süresine dayalı verilere dayanmaktadır. Etkinlik, lokal ileri veya metastatik RET füzyon pozitifliği olan toplam 237 KHDAK hastasında gösterilmiştir. Hastalar, hastalık ilerlemesi veya kabul edilemez toksisite oluşana kadar pralsetinib aldı.
Pralsetinibe FDA onayı getiren klinik çalışma ARROW
Pralsetinibin etkinliği, tümörlerinde RET geentik değişiklikleri olan hastalarda çok merkezli, açık etiketli, çok kohortlu ARROW adlı klinik çalışmada araştırıldı. RET gen değişikliklerinin tanımlanması, yeni nesil dizileme (NGS), floresan hibridizasyon veya diğer testler kullanılarak yerel laboratuvarlarda ileriye dönük olarak belirlendi.
Ana etkililik sonuç ölçütleri genel yanıt oranı (ORR) ve yanıt süresiydi.
RET füzyon pozitif KHDAK'da pralsetinibin etkinliği, daha önce platin kemoterapi ile tedavi edilen 87 hastada değerlendirildi.
- Pralsetinib ile genel yanıt oranı %57 idi.
- Yanıt veren hastaların %80'i 6 ay veya daha uzun süren yanıtlara sahipti.
- Etkinlik ayrıca daha önce sistemik tedavi almayan 27 hastada değerlendirildi. Bu hastalar için genel yanıt oranı %70 idi ve yanıt veren hastaların %58'i 6 ay veya daha uzun süren yanıtlara sahipti.
Laboratuvar anormallikleri dahil en yaygın (>=%25) yan etkiler, artmış aspartat aminotransferaz (AST), azalmış hemoglobin, azalmış lenfositler, azalmış nötrofiller, artan alanin aminotransferaz (ALT), artmış kreatinin, artmış alkalin fosfataz, yorgunluk, kabızlık, kas-iskelet ağrısı, azalmış kalsiyum, hipertansiyon, azalmış sodyum, azalmış fosfat ve azalmış trombosit idi.
Önerilen pralsetinib dozu günde bir kez ağızdan 400 mg'dır. Pralsetinib aç karnına alınır (pralsetinib alımından en az 2 saat önce ve en az 1 saat sonra yiyecek alınmaz).
*
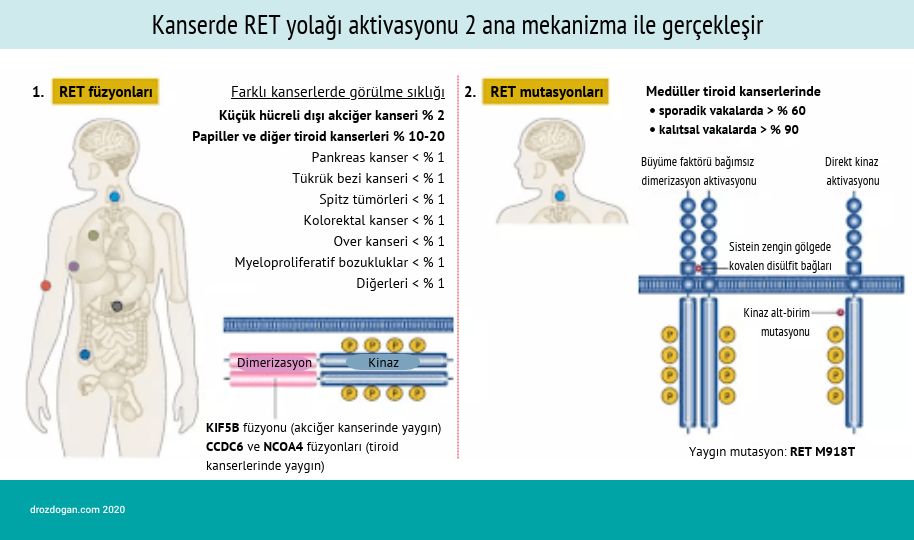
RET gen değişikliklerinin önemi
RET geni, bir proto-onkogendir ve bir tirozin kinaz hücre yüzey reseptörü olan RET reseptörünü kodlar. Bu genin hem işlev kaybı (örneğin Hirschsprung hastalığı) hem de aşırı/yanlış aktivasyonu (örneğin kanserler) çeşitli hastalıklara neden olur.
Aşağıda, RET genetik değişimlerinin çeşitleri ve kanserlerde sıklıkları görülebilir.
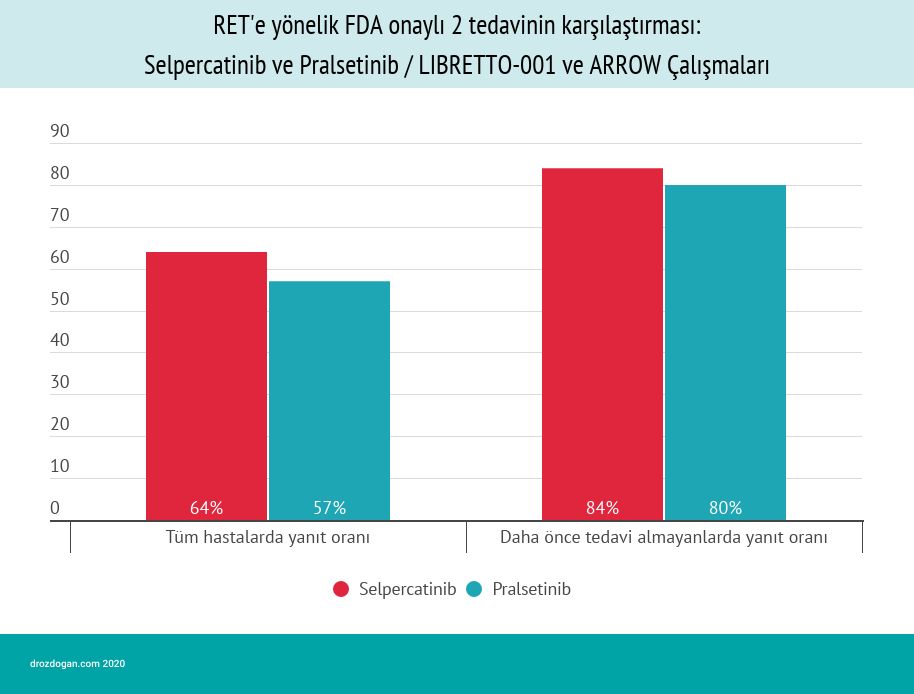
RET pozitif akciğer kanserlerinde FDA onaylı 2 tedavinin karşılaştırılması: Selpercatinib ve Pralsetinib
Pralsetinib, RET genetik değişimlerine özgü olarak FDA onayı alan 2. hedefe yönelik ilaçtır. Daha önce selpercatinib (Retevmo) 8 Mayıs 2020'de tümörlerinde RET genetik değişimi olan küçük hücreli dışı akciğer kanseri, medüller tiroid kanseri ve diğer tiroid kanseri türleri olmak üzere üç tip tümörün tedavisi için FDA onayı almıştı (bakınız ilgili onay yazısı).
Aşağıda, selpercatinib ve pralsetinib "indirekt" karşılaştırmaları görülebilir:
FDA approves pralsetinib for lung cancer with RET gene fusions.
fda.gov - 04.09.2020






