
Safra Yolu Kanseri Birinci Basamak Tedavisi için Pembrolizumab FDA Onayı Aldı
31 Ekim 2023'te ABD Gıda ve İlaç İdaresi (FDA), lokal ilerlemiş, ameliyatla alınamayan veya metastatik safra yolu kanseri tedavisinde gemsitabin ve sisplatin ile birlikte pembrolizumab (Keytruda, Merck) immünoterapisinin kullanılmasını onayladı.
Safra Yolu Kanseri Tedavisi için "İkinci" İmmünoterapi Onayı
Safra yolu kanseri, safra kanalları ve safra kesesinden kaynaklanan, nadir görülen ve sıklıkla agresif bir hastalıktır; ABD'de her yıl yaklaşık 12 bin kişide teşhis edilirken, Türkiye için bu rakamın 2 bin civarı olduğu hesaplanmaktadır. Safra kesesi dışında safra yolu kanserleri, intrahepatik (karaciğer içi), ekstrahepatik (karaciğer dışı) safra yolları olarak ikiye ayrılmaktadır. İmmünoterapinin bu hastalık grubunda kullanımından önce, erken evre intrahepatik safra kanalı kanserleri için 5 yıllık nisbi sağkalım oranı %25 ve erken evre ekstrahepatik safra kanalı kanserleri için sadece %15'tir. Safra yolu kanserlerine, kolanjiokanser de denilmektedir.
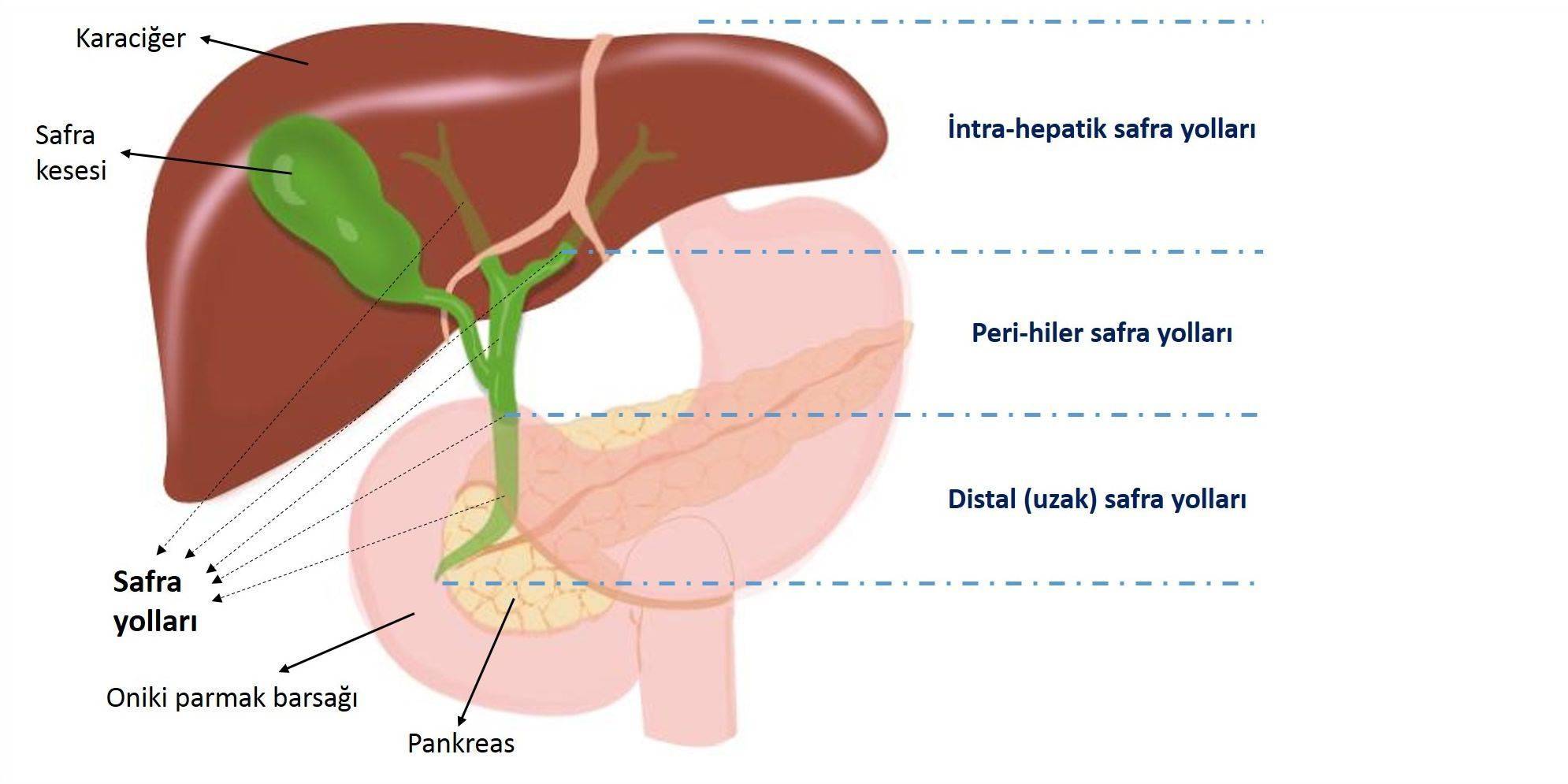
Ameliyat edilemeyen veya 4. evre safra yolu kanserinde eski tedavi standardı, kombine kemoterapi idi ve bu standart on yıldan fazla bir süredir değişmemişti. Bununla birlikte 2 Eylül 2022'de TOPAZ-1 çalışması ile durvalumab immünoterapisine gelen FDA onayı, standart kemoterapiye immünoterapi eklenmesinin safra yolu kanserinde sağkalımı artırabileceğini ve daha da önemlisi, bunu herhangi bir yeni ciddi yan etki yaratmadan yaptığını gösteren ilk faz III klinik araştırmaydı ve safra yolu kanserlerinde immünoterapi kullanımını yeni standart haline getirmişti.
Pembrolizumab KEYNOTE-966 Çalışması ile FDA Onayı Aldı
Etkililik, ileri evre hastalık için daha önce sistemik tedavi almamış, lokal ilerlemiş, ameliyat edilemeyen veya metastatik safra yolu kanserli 1069 hastayı kaydeden çok merkezli, randomize, çift kör, plasebo kontrollü bir çalışma olan KEYNOTE-966'da değerlendirildi.
Deney kolundaki hastalar pembrolizumab artı gemsitabin ve sisplatin; kontrol kolundaki hastalar ise plasebo artı gemsitabin ve sisplatin almak üzere 1:1 oranında randomize edildi.
Tedavi, kabul edilemez toksisiteye veya hastalık ilerlemesine kadar devam etti.
Sisplatin maksimum 8 döngü boyunca uygulandı; gemsitabin tedavisine hekimin kararıyla devam edildi. Pembrolizumab veya plaseboya hastalık ilerleyene, kabul edilemez toksisiteye veya maksimum 2 yıla kadar devam edildi.
Sonuçlar
Başlıca etkililik ölçüsü, genel sağkalım (OS) idi.
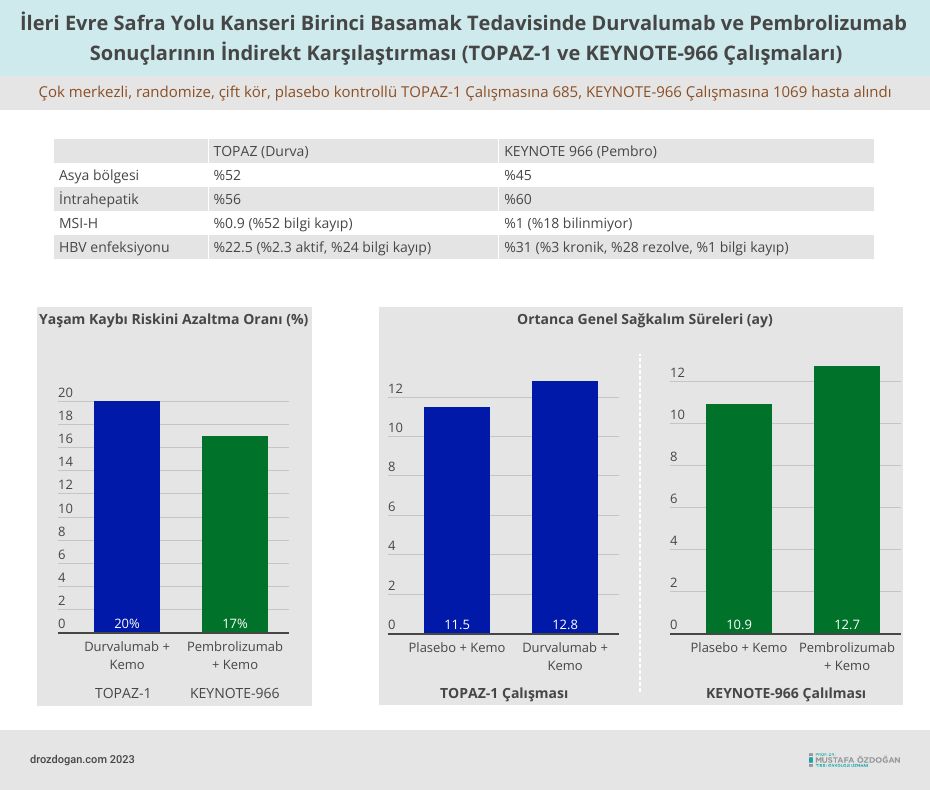
- Pembrolizumab artı kemoterapi, 0,83'lük bir tehlike oranıyla (%95 Güven Aralığı [CI]: 0,72, 0,95); plasebo artı kemoterapiye kıyasla genel sağkalımda istatistiksel olarak anlamlı bir iyileşme gösterdi (tek taraflı p değeri=0,0034). Yani, kemoterapiye pembrolizumab eklenmesi, yaşam kaybı riskini %17 azalttı.
- Ortanca genel sağkalım ilgili kollarda 12,7 ay (%95 GA: 11,5, 13,6) ve 10,9 ay (%95 GA: 9,9, 11,6) idi.
Pembrolizumabın kesilmesine yol açan advers reaksiyonlar hastaların %55'inde meydana geldi. En sık görülen advers reaksiyonlar veya kesintiye yol açan laboratuvar anormallikleri (≥%2) nötrofil sayısında azalma, trombosit sayısında azalma, anemi, beyaz kan hücresi sayısında azalma, ateş, yorgunluk, kolanjit, ALT artışı, AST artışı ve safra tıkanıklığıdır.
Önerilen pembrolizumab dozu, hastalık ilerleyene veya kabul edilemez toksisiteye kadar her 3 haftada bir 200 mg veya 6 haftada bir 400 mg'dır. Pembrolizumab aynı gün verildiğinde kemoterapiden önce uygulanmalıdır.
*
TOPAZ-1 (durvalumab) ve KEYNOTE-966 (pembrolizumab) Sonuçlarının İndirekt Karşılaştırması
FDA approves pembrolizumab with chemotherapy for biliary tract cancer. 31 Oct 2023 https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-pembrolizumab-chemotherapy-biliary-tract-cancer






