Toripalimab İmmünoterapisi Nazofarenks (Geniz) Kanseri Tedavisinde FDA Onayı Aldı
Nazofarenks Kanseri için İlk İmmünoterapi Onayı
27 Ekim 2023'te Amerikan Gıda ve İlaç Dairesi (FDA), toripalimab-tpzi (Loqtorz, Coherus BioSciences) adlı immünoterapi ilacını, sisplatin ve gemsitabin ikili kemoterapisi ile birlikte metastatik veya tekrarlayan, lokal ileri evre nazofarenks karsinomu olan yetişkinlerin birinci basamak tedavisi için onayladı.
FDA, ayrıca, platin-temelli kemoterapi sonrasında hastalık ilerlemesi gösteren tekrarlayan ameliyatla çıkarılamaz veya metastatik nazofarenks kanserli yetişkinler için toripalimab-tpzi'yi tek ajan olarak onayladı (ikinci basamak).
Toripalimab-tpzi, bir anti-PD-1 monoklonal antikoru sınıfından immünoterapidir. Endikasyonlar hastaların PD-L1 durumuna bakılmaksızın geçerlidir .
Bir basın bülteninde, Coherus CEO'su Denny Lanfear, şirketin "şimdi dikkatimizi, tümör mikroçevresini hedefleyen [immüno-onkoloji] ajanları ile birlikte birden fazla tümör tipinde Loqtorzi'yi geliştirmeye çevirmekten" özellikle heyecan duyduğunu söyledi. Bu, şirketin geliştirdiği diğer ajanları da içeriyor.
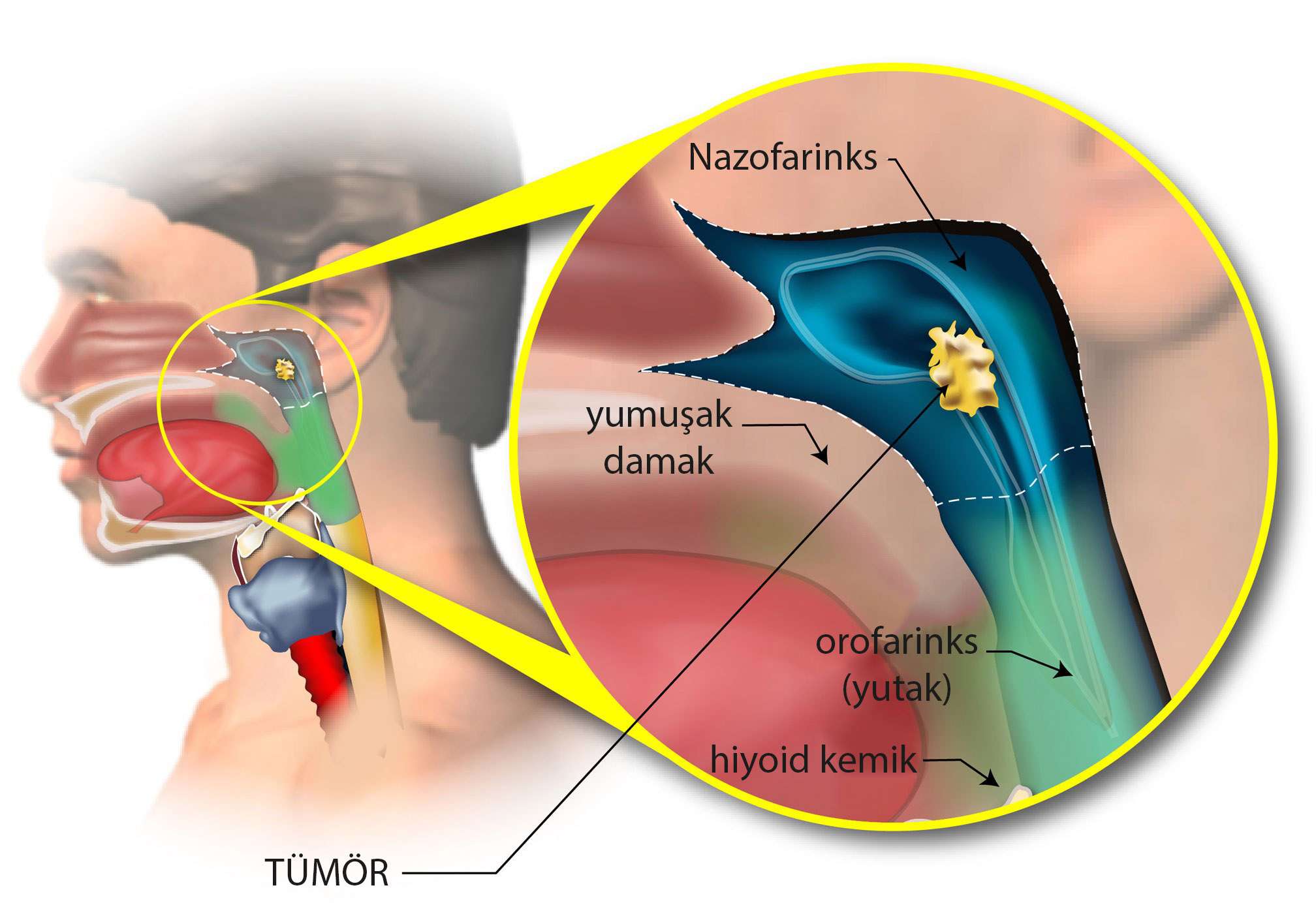
Tıpta nazofarenks olarak ifade ettiğimiz bölgenin Türkçe karşılığı "geniz"dir (bazen "üst yutak" olarak da ifade edilir). Geniz, burun boşluğunun ardından gelir ve ağız boşluğunun üst kısmı ile yutağın (farenks) üst kısmı arasında bulunur. Dolayısıyla, nazofarenks karsinomu terimi, geniz kanseri anlamına gelmektedir.
Aşağıda, nazofarenks (geniz) bölgesinde yer alan bir tümör resmedilmiştir:
Birinci Basamakta FDA Onayı Getiren JUPITER-02 Çalışması
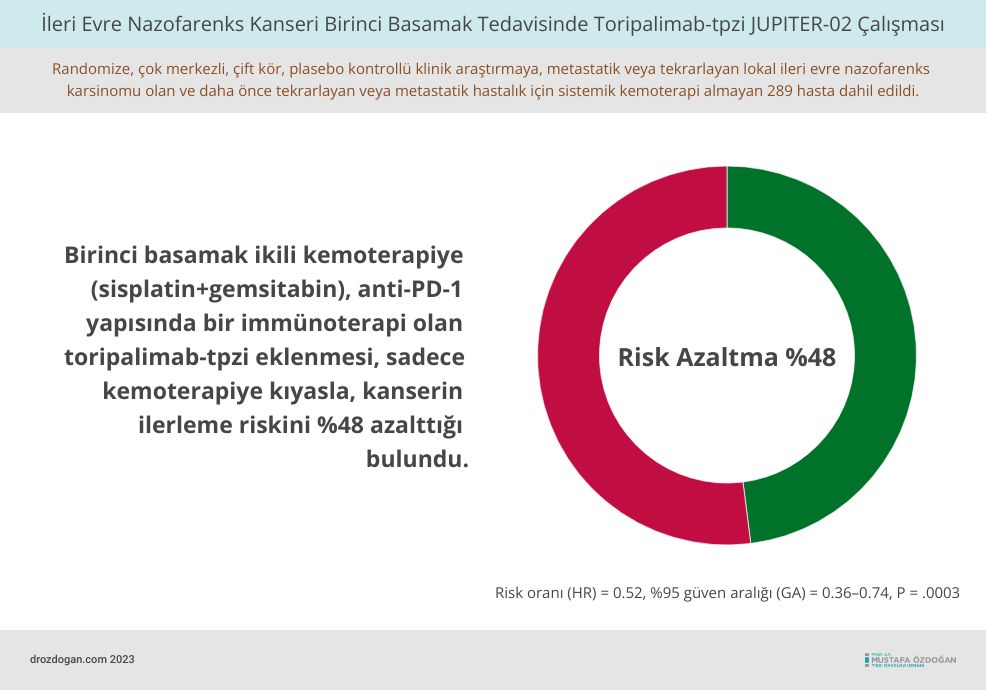
Toripalimab-tpzi'nin sisplatin ve gemsitabine ile etkinliği, metastatik veya tekrarlayan lokal ileri evre nazofarenks karsinomu olan ve daha önce tekrarlayan veya metastatik hastalık için sistemik kemoterapi almayan 289 hastada JUPITER-02 çalışmasında değerlendirildi.
Bu, randomize, çok merkezli, çift kör, plasebo kontrollü bir denemeydi. Hastalar, toripalimab-tpzi ile sisplatin ve gemcitabine almayı takiben toripalimab-tpzi almak veya sisplatin ve gemsitabine almayı takiben plasebo almak üzere 1:1 oranında rastgele atanmıştı.
Birincil etkinlik sonuç ölçütü, progresyonsuz yaşam süresiydi (PFS). Genel yaşam süresi ek bir son noktaydı.
İstatistiksel olarak anlamlı bir progresyonsuz yaşam süresi artışı, toripalimab-tpzi ve plasebo içeren tedavi protokolleri için sırasıyla ortanca 11.7 ay ve 8 ay olarak gözlemlendi (risk oranı [HR] = 0.52, %95 güven aralığı [CI] = 0.36–0.74, P = .0003).
İstatistiksel olarak anlamlı bir genel yaşam süresi artışı da kaydedildi; toripalimab-tpzi içeren tedavi protokolü için ortanca genel yaşam süresi belirlenemezken (%95 güven aralığı = 38.7 aydan tahmin edilemez), plasebo içeren tedavi protokolü için 33.7 ay (%95 güven aralığı = 27.0–44.2 ay) olarak saptandı (risk oranı [HR] = 0.63, %95 güven aralığı [CI] = 0.45–0.89, P = .0083).
İkinci Basamakta FDA Onayı Getiren POLARIS-02 Çalışması
Toripalimab-tpzi'nin tek ajan olarak etkinliği, daha önce platin-temelli kemoterapi almış veya platin-temelli kemoterapi tamamlandıktan sonraki 6 ay içinde hastalık ilerlemesi gösteren ameliyatla çıkarılamaz veya metastatik nazofarenks karsinomu olan 172 hastada POLARIS-02 çalışmasında değerlendirildi.
Bu, açık etiketli, çok merkezli, tek ülkeli, çok kohortlu bir denemeydi. Hastalar, hastalık ilerlemesi veya kabul edilemez toksisiteye kadar toripalimab-tpzi aldı.
Ana etkinlik sonuç ölçütleri, genel yanıt oranı ve yanıt süresiydi.
- Genel yanıt oranı %21 (%95 CI = %15–%28) ve ortanca yanıt süresi 14.9 ay (%95 CI = 10.3 aydan tahmin edilemez) idi.
Yan Etkiler
İmmünoterapi ilişkili yan etkiler, toripalimab-tpzi ile meydana geldi, bunlar arasında pnömonit, kolit, hepatit, endokrinopatiler, renal disfonksiyon ile nefrit ve deri advers reaksiyonları bulunuyordu.
Toripalimab-tpzi ile sisplatin ve gemsitabin kombinasyonu için en yaygın (%≥ 20) advers reaksiyonlar bulantı, kusma, iştah azalması, kabızlık, hipotiroidizm, döküntü, ateş, ishal, periferik nöropati, öksürük, kas-iskelet ağrısı, üst solunum yolu enfeksiyonu, uykusuzluk, baş dönmesi ve halsizlik idi.
Toripalimab-tpzi için tek ajan olarak en yaygın (%≥ 20) advers reaksiyonlar yorgunluk, hipotiroidizm ve kas-iskelet ağrısı idi.
Tavsiye edilen toripalimab-tpzi dozu sisplatin ve gemsitabin ile birlikte hastalık ilerlemesi, kabul edilemez toksisite veya en fazla 24 ay olmak üzere her 3 haftada bir 240 mg'dir. Daha önce tedavi edilen nazofarenks karsinomu için tavsiye edilen toripalimab-tpzi dozu, hastalık ilerlemesi veya kabul edilemez toksisiteye kadar her 2 haftada bir 3 mg/kg'dır.
FDA approves toripalimab-tpzi for nasopharyngeal carcinoma. 27 Oct 2023. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-toripalimab-tpzi-nasopharyngeal-carcinoma






