
Tremelimumab-Durvalumab İkili İmmünoterapi Rejimi, Akciğer Kanserinde FDA Onayı Aldı
Metastatik (4. evre) küçük hücreli dışı akciğer kanseri (KHDAK) olan, EGFR veya ALK mutasyonları taşımayan yetişkin hastalar için platin bazlı kemoterapi ile kombinasyon halinde tremelimumab (Imjudo, AstraZeneca) ve durvalumab (Imfinzi, AstraZeneca) immünoterapi kombinasyonu, 10 Kasım 2022'de FDA (ABD Gıda ve İlaç idaresi) onayı aldı.
Tremelimumab artı Durvalumab Kombinasyonu için 2. FDA Onayı
Bu, anti-CTLA4 ajan tremelimumab ve anti-PD-L1 ajan durvalumab immünoterapi kombinasyonu için 2. FDA onayıdır. Daha önce bu kombinasyon, Ekim 2022'de ileri evre karaciğer kanseri için onay almıştı.
KHDAK Birinci Basamak Tedavisinde 5. İmmünoterapi-Kemoterapi Onayı
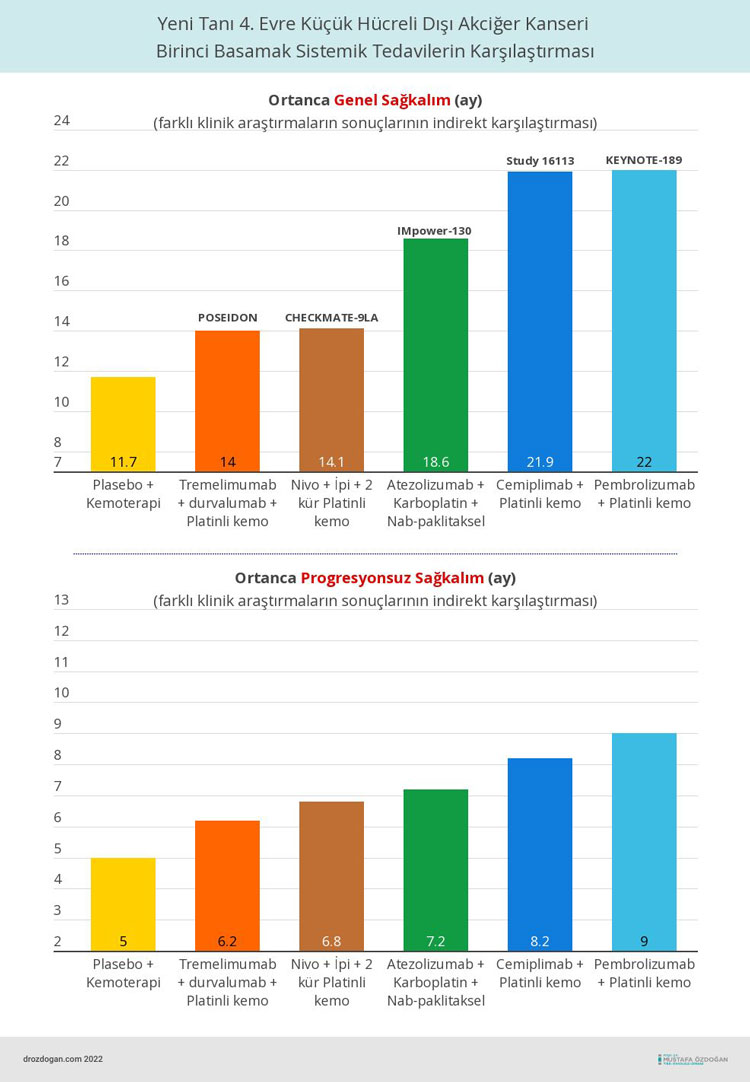
Bu immünoterapi-kemoterapi kombinasyonu, ileri evre küçük hücreli dışı akciğer kanseri (KHDAK) birinci basamak tedavisinde, PD-L1'den bağımsız bir şekilde FDA onayı alan 5. tedavi oldu. Daha önce "pembrolizumab", "atezolizumab", "nivolumab-ipilimumab" ve "cemiplimab" immünoterapileri, platin-bazlı kemoterapi ile kombinasyon halinde, bu durumdaki hastaların tedavisinde kullanılmak üzere onay almıştı.
POSEIDON Çalışması ile Gelen FDA Onayı
Platin-bazlı kemoterapi ile tremelimumab-durvalumabın etkinliği, daha önce sistemik tedavi almamış metastatik KHDAK'li hastalarda randomize (1:1:1), çok merkezli, aktif kontrollü, açık etiketli bir çalışma olan POSEIDON'da değerlendirilmiştir.
Hastalar üç tedavi kolundan birine randomize edildi:
- Dört döngü için tremelimumab, durvalumab ve platin bazlı kemoterapi, ardından her 4 haftada bir durvalumab ve idame kemoterapisi. Hastalar 16. haftada beşinci tremelimumab dozu ile tedavi edildi;
- Dört döngü için durvalumab artı platin bazlı kemoterapi, ardından durvalumab ve idame kemoterapisi; veya
- Altı döngü için platin bazlı kemoterapi ve ardından idame kemoterapisi.
Tedavi, hastalık progresyonuna (ilerleme) veya kabul edilemez yan etkiye kadar sürdürüldü. Bu onay, tedavi kolu 1 ve 3'ün (675 hasta) karşılaştırmasına dayanmaktadır.
Başlıca etkililik sonuç ölçütleri, progresyonsuz sağkalım ve genel sağkalım idi.
Sonuçlar
Tremelimumab artı durvalumab ve platin bazlı kemoterapi, sadece platin bazlı kemoterapiye kıyasla genel sağkalımda istatistiksel ve klinik olarak anlamlı bir iyileşme gösterdi: yaşam kaybı riskinde %23 azalma (tehlike oranı [HR] 0,77 [%95 GA: 0,65, 0,92], 2 taraflı p değeri = 0,00304 ).
Ortanca genel sağkalım, kombine immünoterapi kolunda 14 ay (%95 GA: 11.7, 16.1) ve sadece kemoterapi kolunda 11.7 ay (%95 GA: 10.5, 13.1) idi.
Ortanca progresyonsuz sağkalım, tedavi kollarında sırasıyla 6.2 ay (%95 GA: 5.0, 6.5) ve 4.8 ay (%95 GA 4.6, 5.8) idi (HR 0.72 [%95 GA: 0.60, 0.86], 2 taraflı p değeri = 0.00031).
Genel yanıt oranı, tedavi kolu 1 ve 3'te sırasıyla %39 (%95 GA: 34,44) ve %24 (%95 GA: 20, 29) idi. Ortanca yanıt süresi, immünoterapi tedavi kolunda 9,5 ay (%95 GA: 7,2, ulaşılamadı) ve 5,1 aydı (%95 GA: 4,4, 6,0).
En yaygın (hastaların ≥ %20'sinde meydana gelen) yan etkiler bulantı, yorgunluk, iştah azalması, kas-iskelet ağrısı, döküntü ve ishaldir. Derece 3 veya 4 laboratuvar anormallikleri (≥ %10) nötropeni, anemi, lökopeni, lenfositopeni, lipaz artışı, hiponatremi ve trombositopenidir.
Ağırlığı 30 kg veya daha fazla olan hastalar için önerilen dozlar şöyledir: ilk 4 döngü tedavi için her 3 haftada bir tremelimumab 75 mg, durvalumab 1500 mg IV ve platin-bazlı kemoterapi. Ardından 4 haftada bir idame kemoterapisi ile durvalumab 1500 mg'dır. Beşinci tremelimumab dozu 75 mg olarak 16. haftada verilmelidir.
Yukarıdaki çizelgeye göre, 30 kg veya daha hafif hastalar için önerilen tremelimumab dozu 1 mg/kg ve durvalumab dozu 20 mg/kg'dır.
FDA approves tremelimumab in combination with durvalumab and platinum-based chemotherapy for metastatic non-small cell lung cancer. fda.gov 11.10.2022






