Avrupa İlaç Ajansı, Küçük Hücreli Akciğer Kanserinde En Etkili Bulunan Tedaviyi Onayladı
Avrupa İlaç Ajansı (EMA= European Medicines Agency), 19 Eylül 2024'te, yaygın evre küçük hücreli akciğer kanserini tedavi etmek amacıyla serplulimab etken maddeli Hetronifly (Henlius Europe) adlı immünoterapinin Avrupa Birliği ülkelerinde pazarlama izni verilmesini öneren olumlu görüş bildirdi.
Küçük hücreli akciğer kanseri (KHAK), hızlı büyüme ve erken yayılma özellikleri nedeniyle genellikle agresif tedavi yaklaşımlarını gerektiren bir hastalıktır ve tüm akciğer kanserlerinin %15 kadarını oluşturmaktadır. Bu kanser türü, sigara içenler arasında daha sık görülmekte ve tanı konulduğunda genellikle metastaz yapmış, yaygın evre durumundadır. Standart tedavi yöntemleri arasında kemoterapi uzun yıllar en etkili seçenek olarak kabul edilmiştir. Ancak son yıllarda immünoterapinin bu tedavilere eklenmesi ile sağkalım oranlarında ciddi iyileşmeler görülmüştür.
Bu bağlamda, son gelişmeler ışığında öne çıkan tedavi seçeneklerinden biri serplulimab adlı immünoterapi ajanıdır. Serplulimab, Avrupa'da faaliyet gösteren ancak kökeni Çin olan Henlius biyoteknoloji şirketi tarafından geliştirilen bir anti-PD-1 antikorudur ve ilk olarak Çin'de onay almıştır. 19 Eylül'de Avrupa İlaç Ajansı (EMA), serplulimabın Avrupa'da da pazarlama izni alması yönünde tavsiyede bulunmuştur. Bu yazıda, serplulimabın ileri evre küçük hücreli akciğer kanseri tedavisinde sağkalım sonuçları üzerindeki etkilerine değineceğiz ve ASTRUM-005 çalışmasının bulgularını inceleyeceğiz.
ASTRUM-005 Çalışması: Serplulimab ile En Uzun Sağkalım Sonuçları
ASTRUM-005 çalışması, yaygın evre küçük hücreli akciğer kanseri (YE-KHAK) hastalarının tedavisinde serplulimabın kemoterapiye eklenmesinin etkinliğini inceleyen bir faz III klinik araştırmadır. Bu çalışmada, serplulimabın genel sağkalım ve progresyonsuz sağkalım üzerindeki etkileri değerlendirildi.

Çalışmaya katılan 585 hasta arasında, serplulimab grubunda sağkalım sonuçları çarpıcı bir şekilde iyileşmiştir:
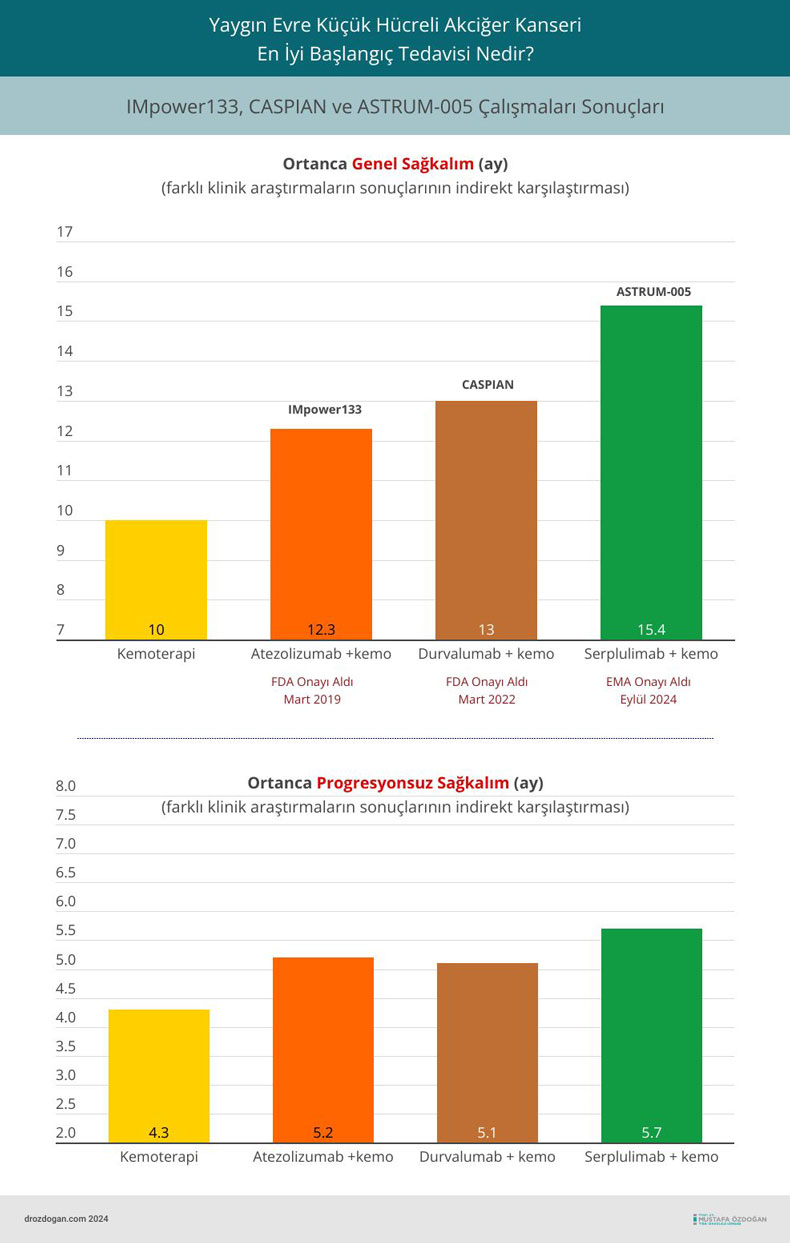
- Ortanca genel sağkalım, serplulimab + kemoterapi grubunda 15,4 ay olarak raporlanmış, plasebo grubunda ise bu süre 10,9 ay olmuştur. Bu veriler, tedavi gören hastaların yaklaşık 5 ay daha uzun yaşadığını göstermektedir (HR: 0,63).
- Ortanca progresyonsuz sağkalım, serplulimab ile tedavi edilen hastalarda 5,7 ay olurken, plasebo grubunda 4,3 ay olarak kaydedilmiştir (HR: 0,48).
Bu sonuçlar, serplulimabın, YE-KHAK tedavisinde oldukça etkili olduğunu ve mevcut tedavi seçeneklerine göre sağkalımı önemli ölçüde uzattığını göstermektedir.
Aşağıda, YE-KHAK birinci basamak tedavisinde dikkat çeken 3 çalışmanın sonuçlarının indirekt karşılaştırması görülebilir.
Yan Etkiler ve Güvenlik Profili
Serplulimab tedavisinin yan etkileri arasında, hipotiroidizm ve hipertiroidizm gibi immün sistemle ilişkili etkiler daha sık görülmüştür. Ciddi (derece ≥ 3) yan etkiler serplulimab grubunda %33,2 oranında, kontrol grubunda ise %27,6 oranında rapor edilmiştir. Genel olarak tedavi, kemoterapi ile birlikte kullanıldığında güvenli bir profil sergilemiştir.
EMA'nın Hetronifly İçin Tavsiyesi: Yeni Bir Dönemin Başlangıcı
EMA'nın serplulimab (Hetronifly) için yaptığı tavsiye, Avrupa'da bu tedaviye erişim sağlanması açısından büyük bir adım olarak değerlendirilmektedir. Avrupa İlaç Ajansı, serplulimabın, kemoterapiyle kombinasyon halinde kullanıldığında sağkalım süresini ve tedavi yanıtını belirgin şekilde artırdığına dair güçlü kanıtlar sunmuştur. Bu durum, özellikle ileri evre küçük hücreli akciğer kanseri olan hastalar için yeni bir umut kaynağıdır.
Sonuç: Küçük Hücreli Akciğer Kanseri Tedavisinde Yeni Bir Standart
İleri evre küçük hücreli akciğer kanseri tedavisinde immünoterapinin önemi giderek artmaktadır. Serplulimab, bu hastalık grubunda en iyi sağkalım sonuçlarını sağlayan tedaviler arasında yerini almıştır. FDA ve EMA onaylarının tam olarak alınması durumunda, serplulimab, global ölçekte standart tedavi seçenekleri arasında yer alacaktır. Bu gelişme, özellikle uzun süreli sağkalım sonuçları açısından büyük bir fark yaratabilecek potansiyele sahiptir.
FDA ve EMA Onay Farkları
FDA (Amerikan Gıda ve İlaç Dairesi) ve EMA (Avrupa İlaç Ajansı) onayları, tıbbi ürünlerin, ilaçların ve tıbbi cihazların güvenlik, etkinlik ve kalite standartlarına uygun olduğunun kanıtlanması için verilen düzenleyici onaylardır. Ancak bu iki kurumun onay süreçleri, yetki alanları ve değerlendirme kriterleri arasında bazı farklar vardır.
FDA ve EMA Onay Farkı:
-
Yetki Alanı:
- FDA: ABD'deki ilaçlar, biyolojik ürünler, tıbbi cihazlar ve gıda maddeleri üzerinde düzenleyici yetkiye sahiptir. FDA onayı, ABD'de bir ürünün pazarlanabilmesi için gereklidir.
- EMA: Avrupa Birliği (AB) ülkelerindeki ilaçların güvenliğini ve etkinliğini denetler. EMA onayı, AB ülkelerinde bir ürünün pazarlanabilmesi için gereklidir.
-
Değerlendirme Süreci:
- FDA: Değerlendirme süreci genellikle daha merkezi ve doğrudan FDA tarafından yapılır. Bir ürün ABD'de piyasaya sürülmeden önce genellikle kapsamlı faz III klinik çalışmaları sonuçlandırılmalıdır. FDA, başvuruyu doğrudan inceleyen bir otoritedir ve genellikle uzun ve detaylı bir süreçten geçer.
- EMA: EMA, ilaçların değerlendirmesini AB üyesi ülkelerdeki bağımsız uzmanlar ve komiteler aracılığıyla gerçekleştirir. EMA onayı, AB genelinde geçerli olan "merkezi bir pazarlama izni" sağlar ve AB üye ülkelerinde uygulanır. Süreç, daha çok bir topluluk içinde değerlendirme şeklinde işler.
-
Kapsam:
- FDA: FDA yalnızca ABD'deki ürünler için karar verir.
- EMA: EMA'nın verdiği karar AB genelinde geçerlidir ve birçok Avrupa ülkesini kapsar.
FDA Onayı Olmadan EMA Onayı Almak Mümkün Müdür?
Evet, FDA onayı olmadan EMA onayı almak mümkündür. Bir ilacın ya da tıbbi ürünün onay süreci, her düzenleyici kurumun kendi kriterlerine ve zaman çizelgesine bağlıdır. Örneğin, bir ilaç Avrupa'da daha erken başvurulabilir ve daha önce onay alabilir, ancak ABD'de daha geç onaylanabilir. Bunun anlamı, bir ilacın bir bölgede pazarlanıp başka bir bölgede henüz onay almamış olabilmesidir.
EMA Onayı Almasının Anlamı:
- EMA onayı, bir ilacın Avrupa Birliği ve Avrupa Ekonomik Alanı ülkelerinde pazarlanabilir olduğu anlamına gelir. Bu, ürünün Avrupa pazarına girebileceği ve orada kullanılabileceği anlamına gelir.
- FDA onayı olmadan EMA onayı alınması, ilacın veya tedavi yönteminin ABD dışındaki ülkelerde güvenli ve etkili olduğu sonucunu verir, ancak ABD'de piyasaya sürülebilmesi için ek onay gerekecektir.
Bu süreç, ülkeler veya bölgeler arasında düzenleyici farklılıkların olabileceğini ve bir ilacın bir yerde onaylanmış olsa bile başka bir yerde henüz onaylanmamış olabileceğini gösterir. Örneğin, Serplulimab’ın EMA onayı alması, Avrupa’da kullanımının güvenli ve etkili bulunduğunu gösterir, ancak FDA onayı olmadan ABD pazarına girmesi mümkün değildir.
Sonuç olarak, bu durum küresel pazara girişte farklılıklar yaratabilir, ancak FDA ve EMA'nın onay süreçleri bağımsız olduğu için bir ilaç her iki kuruma da başvurabilir ve onay alabilir.
Hetronifly. 19 Sep 2024. https://www.ema.europa.eu/en/medicines/human/EPAR/hetronifly






